קשר דליגת מטען
תוכן עניינים
קשר דליגת מטען - Charge Shift Bond
מושג חדש לגבי קישור כימי בין אל-מתכות
על-פי הרצאתו של פרופ' ששון צחייק, מכון מינרווה ליזה מייטנר לכימיה קוונטית חישובית
מבוא
ישנן 3 שיטות חישוביות מקובלות כיום לחישובים קוונטומכניים המתייחסים לקישור כימי:
- MO – אורביטלים מולקולריים – Molecular Orbitals
- VB – תורת הקשר הערכי – Valence Bond
- DFT – תורת פונקציונל צפיפות המטען – Density Functional Theory
העבודה על פיתוח המושג קשר דליגת מטען (קשר CS) נעשתה בעזרת חישובי VB, בגיבוי שיטות חישוביות ונסיונות נוספות. עפ"י גישת Valence Bond) VB) –
כאשר פותרים משוואת שרדינגר לקבלת פונקצית גל המתארת את התנהגות האלקטרונים הקושרים המשותפים לשני האטומים המשתתפים בקשר, הפתרון יהיה קומבינציה לינארית של 3 פונקציות:
(אם האטומים בקשר הנם A ו- X ) הפונקציות יהיו אחת קוולנטית טהורה ושתיים יוניות, והפתרון יראה כך –
PsiA-X = c1 Psi(A-X) + c2 Psi (A+ X-) + c3 Psi(A- X+)
- כאשר הקשר הוא בעיקרו קוולנטי טהור, יהיה המקדם הראשון c1 קרוב ל-1, והתרומות היוניות זניחות,
- כאשר הקשר הוא יוני – יהיה אחד המקדמים של הפונקציות היוניות c2 או c3 קרוב ל- 1.
- ואילו בקשר קוולנטי קוטבי – המקדם של הפונקציות הקוולנטית הטהורה ואחת הפונקציות היוניות יהיו משמעותיים, בהתאם להפרש ערכי האלקטרושליליות.
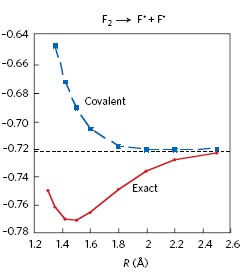
מבחינת ערכי אנרגית הקשר מוגדרת אנרגית רזוננס (RE) שהיא ההפרש בין אנרגית הקשר הקוולנטי הטהור, לאנרגית הקשר המחושבת לפונקציה הכוללת –
RE = DA-X - Dcov
- כאשר הקשר הנו בעיקרו קוולנטי טהור – אנרגית הרזוננס נמוכה.
- כאשר יש פער גדול – הרזוננס הוא מה שמייצב את הקשר.
עפ"י כל האמור לעיל – היינו מצפים למצוא את כל הקשרים המסווגים על-ידינו כקוולנטיים טהורים, למשל כל הקשרים ההומונוקלארים (קשרים בין אטומים זהים), כבעלי אנרגית רזונס מינימלית. כאשר בדקו התגלה שקשרים רבים, הינם בעלי ערך מאוד גבוה של אנרגית הרזוננס, גם כאשר אינם יוניים או קוטביים מאוד.
כאשר בחנו את ערכי 3 המקדמים בקומבינציה הליניארית של משוואת הגל בקשרים הללו, התגלה שהמקדם של הצורה הקוולנטית הטהורה זניח, אולם 2 המקדמים של הצורות היוניות בעלי ערך משמעותי. ניתן לדמות מצב שבו זוג אלקטרוני הקשר נמצאים בעיקר משני עברי האטומים הקשורים, כך שכשהם קרובים לאחד האטומים, הוא מהווה את היון השלילי, ונמשך בכח אלקטרוסטטי לאטום השני שמהווה יון חיובי. מתקיים מצב רזוננס בין 2 הצורות היוניות ההפוכות.
לקשר שמתבסס על התנהגות כזו – קראו "קשר דליגת מטען" –Charge Shift Bond (להלן קשר CS).
קשר CS נוטה להיווצר בין אטומים קומפקטיים (קטנים) בעלי מס' רב של זוגות אלקטרונים לא קושרים עליהם.
עבור המולקולה F2 התגלה ע"י חישוב קוונטו-מכני שהאנרגיה הפוטנציאלית של הפונקציה הקוולנטית הטהורה – הינו פוטנציאל דוחה. מתחייב אם כך שמה שיגרום לזוג האטומים להיקשר יהיה קשר ה- CS, המתבסס על התרומות היוניות והרזוננס, לטובת הקשר בין האטומים.
בדיקת תקפות התיאוריה - בעזרת שיטות נוספות וניסיונות
בעזרת 2 שיטות חישוביות שונות ELF ו- AIM מתגלה שבמולקולות "קוולנטיות" שמתאימות למודל קשר CS, כלומר בעלות אנרגיית רזוננס גבוהה, (ערך RE גבוה) – צפיפות המטען גבוהה לא באזור שבין האטומים אלא משני עברי האטומים. בעזרת מדידות שמבוססות על קרני X, ניתן להעריך את צפיפות המטען. עבור הקשרים הבאים נמצאו קשרים חסרי צפיפות מטען באזור שבין האטומים (No Density Bond):
C-F, C-N, N-N, N-O, O-O, F-F
תיאורית קשר דליגת המטען, נותנת הסבר לממצאים הנ"ל.
תוצאה מעניינת נוספת
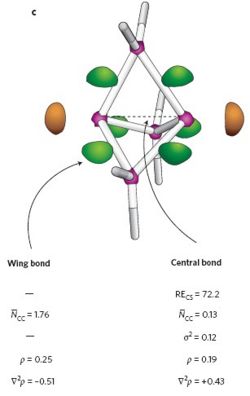
מולקולת הפרופלן – 2 אטומי פחמן, המחוברים בקשר יחיד, שעליהן 3 טבעות משולשות בעלות מתילן CH2, בקודקוד. (ראו ציור משמאל) הקשר בין 2 הפחמנים בציר הסימטריה הסבובי של המולקולה הינו קשר מהופך. הוא בכיוון הפוך לצפוי מהגיאומטריה הטטרהדרלית המוכרת של 4 הקשרים סביב פחמן. קשר CS נמצא כהסבר מתאים ליכולת ליצור מולקולה כזו. צפיפות המטען חושבה כממוקמת משני צידי הפחמנים בקשר המרכזי, , ולכן המחשבה על דחייה בלתי אפשרית בין זוגות האלקטרונים, בהתאם לקונספציה הרגילה של קשרים קוולנטיים אינה מתאימה. יש לציין ששאר קשרי C-C במולקולה, מתנהגים כקשרים קוולנטיים לכל דבר, וצפיפות המטען של אלקטרוני הקשר נמצאת באזור בין הגרעינים.