קוטביות מולקולה: הבדלים בין גרסאות
(←'''קוטביות מולקולה''') |
מ (קוטביות מולקולה הועבר לקוטביות מולקולה) |
||
| (15 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | ='''קוטביות מולקולה'''= | + | = '''קוטביות מולקולה''' = |
| − | מולקולה קוטבית היא מולקולה שהענן האלקטרוני שלה אינו מחולק בצורה סמטרית. אי הסימטריה בהסתדרות האלקטרונים סביב המולקולה יוצרת דו קוטב קבוע. כלומר הענן האלקטרוני באיזור אחד של המולקולה צפוף יותר מהאיזור | + | מולקולה קוטבית היא מולקולה שהענן האלקטרוני שלה אינו מחולק בצורה סמטרית. אי הסימטריה בהסתדרות האלקטרונים סביב המולקולה יוצרת דו קוטב קבוע. כלומר הענן האלקטרוני באיזור אחד של המולקולה צפוף יותר מהאיזור האחר. איזור שבו הענן האלקטרוני צפוף יותר יש מיסוך טוב למטענים החיוביים של הגרעינים לכן למעשה באיזור זה יש מטען חלקי שלילי , ובאיזור שהענן האלקטרוני דליל אין מיסוך טוב של המטענים החיוביים של הגרעינים לכן האיזור הוא למעשה אזור של מטען חלקי חיובי |
| + | <br>[[Image:Anim2.gif|frame|אנימציה של קשר קוולנטי קוטבי]] <br> | ||
| − | + | '''דוגמא למולוקה קוטבית-המולקולה מימן כלורי HCl''' | |
| − | + | ||
| − | + | ה[[אלקטרושליליות|אלקטרושליליות]] של המימן היא 2.1 ואילו של הכלור היא 3.0 . כלומר אטום מושך אליו אלקטרונים במידה רבה יותר מאשר אטום המימן. לכן במולקולת המימן כלורי הענן האלקטרוני אינו סימטרי, יש סיכוי רב יותר למצוא את זוג אלקטרוני המשותף בקרבת הכלור מאשר בקרבת המימן. אפשר להגיד שהענן האלקטרוני צפוף יותר ליד אטום הכלור והוא דליל יותר ליד אטום המימן. לכן אטום הכלור יהי בעל מטען חלקי שלילי ואילו אטם המימן בעל מטען חלקי חיובי | |
| − | + | [[Image:HcL.png|thumb|left|250px|מודל שמדגים את הקוטביות של מולקולת מימן כלורי]] | |
| − | [[ | + | |
| + | |||
| + | == '''האם קשר קוולנטי קוטבי גורם בהכרח למולקולה להיות קוטבית?''' == | ||
| + | |||
| + | הקשרים הקוולנטיים הקוטביים במולקולה אינם גורמים בהכרח למולקולה להיות קוטבית למשל החומר פחמן דו חמצני O=C=O, הקשר (C=O)הוא [[קשר קוולנטי|קשר קוולנטי]] קוטבי אבל בסך הכל חלוקת המטען על פני המולקולה הוא סימטרית , המטען השלילי סביב שני החמצנים זהה [[Image:CO2.gif|thumb|center|250px|NUSKמודל של מולקולת פחמן דו חמצני]] | ||
| + | |||
| + | == '''מתי המולקולה קוטבית?''' == | ||
| + | |||
| + | == == | ||
| + | |||
| + | == גורמים המשפיעים על קוטביות המלקולה: == | ||
| | ||
| − | + | 1. קשר קוולנטי קוטבי: אטומים שונים באלקטרושליליות יוצרים את הקשרים הקוולנטיים הקוטביים | |
| + | |||
| + | 2. צורה גיאומטרית של המולקולה: הצורות הגיאומטריות השונות יוצרות אורבטלים מולקולאריים בעלי צורות שונות , האורבוטלים יכולים להיות סימטריים מבחינת צפיפות המטען החשמלי או אי סימטריים מבחינת צפיפות המטען.רק בתנאי שהאורביטלים אינם | ||
| − | + | ='''היבטים פדגוגיים'''= | |
| − | + | הקובץ הבא כולל סיכום של הקשר בין מבנה המלוקולה וקוטביותה | |
| − | + | [[מדיה:Polarity.doc|טבלת סיכום קוטביות מולקולה]] | |
| + | ='''קישורים חיצוניים'''= | ||
| + | לערך קוטביות מולקולה באתר ויקיפידיה [http://en.wikipedia.org/wiki/Chemical_polarity לחץ כאן] | ||
גרסה אחרונה מתאריך 21:49, 15 באוגוסט 2013
תוכן עניינים
קוטביות מולקולה
מולקולה קוטבית היא מולקולה שהענן האלקטרוני שלה אינו מחולק בצורה סמטרית. אי הסימטריה בהסתדרות האלקטרונים סביב המולקולה יוצרת דו קוטב קבוע. כלומר הענן האלקטרוני באיזור אחד של המולקולה צפוף יותר מהאיזור האחר. איזור שבו הענן האלקטרוני צפוף יותר יש מיסוך טוב למטענים החיוביים של הגרעינים לכן למעשה באיזור זה יש מטען חלקי שלילי , ובאיזור שהענן האלקטרוני דליל אין מיסוך טוב של המטענים החיוביים של הגרעינים לכן האיזור הוא למעשה אזור של מטען חלקי חיובי
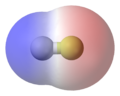
דוגמא למולוקה קוטבית-המולקולה מימן כלורי HCl
האלקטרושליליות של המימן היא 2.1 ואילו של הכלור היא 3.0 . כלומר אטום מושך אליו אלקטרונים במידה רבה יותר מאשר אטום המימן. לכן במולקולת המימן כלורי הענן האלקטרוני אינו סימטרי, יש סיכוי רב יותר למצוא את זוג אלקטרוני המשותף בקרבת הכלור מאשר בקרבת המימן. אפשר להגיד שהענן האלקטרוני צפוף יותר ליד אטום הכלור והוא דליל יותר ליד אטום המימן. לכן אטום הכלור יהי בעל מטען חלקי שלילי ואילו אטם המימן בעל מטען חלקי חיובי
האם קשר קוולנטי קוטבי גורם בהכרח למולקולה להיות קוטבית?
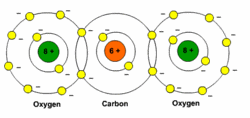
הקשרים הקוולנטיים הקוטביים במולקולה אינם גורמים בהכרח למולקולה להיות קוטבית למשל החומר פחמן דו חמצני O=C=O, הקשר (C=O)הוא קשר קוולנטי קוטבי אבל בסך הכל חלוקת המטען על פני המולקולה הוא סימטרית , המטען השלילי סביב שני החמצנים זההמתי המולקולה קוטבית?
גורמים המשפיעים על קוטביות המלקולה:
1. קשר קוולנטי קוטבי: אטומים שונים באלקטרושליליות יוצרים את הקשרים הקוולנטיים הקוטביים
2. צורה גיאומטרית של המולקולה: הצורות הגיאומטריות השונות יוצרות אורבטלים מולקולאריים בעלי צורות שונות , האורבוטלים יכולים להיות סימטריים מבחינת צפיפות המטען החשמלי או אי סימטריים מבחינת צפיפות המטען.רק בתנאי שהאורביטלים אינם
היבטים פדגוגיים
הקובץ הבא כולל סיכום של הקשר בין מבנה המלוקולה וקוטביותה
קישורים חיצוניים
לערך קוטביות מולקולה באתר ויקיפידיה לחץ כאן