חומרים מתכתיים: הבדלים בין גרסאות
חזן ×× ×” (שיחה | תרומות) |
מ (חומרים מתכתים הועבר לחומרים מתכתיים) |
||
| (9 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 33: | שורה 33: | ||
הקשר הוא קשר שיתופי. | הקשר הוא קשר שיתופי. | ||
| − | == המודל הקוונטי == | + | == המודל הקוונטי == |
| + | |||
| + | המודל הקוונטי מאפשר להסביר את תכונות ההולכה אף יותר לעומק. | ||
| + | |||
| + | במתכת נוצרים מעין "פסי הולכה" של [http://movilim.wiki.co.il/index.php/%D7%90%D7%95%D7%A8%D7%91%D7%99%D7%98%D7%9C אורביטלים] קושרים ובלתי קושרים, ברצף מסויים. | ||
| + | |||
| + | לדוגמא, בנתרן, כל אטום נתרן תורם אורביטל s3 אחד ואלקטרון אחד למבנה הפסים. | ||
| + | |||
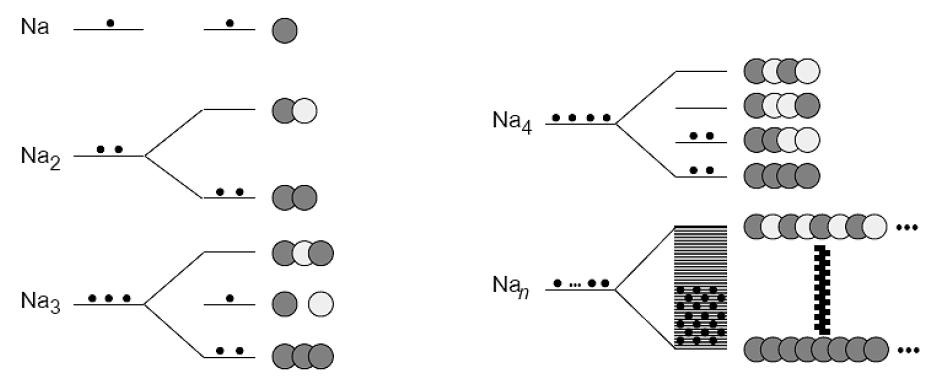
| + | כך נוצרים מ-n אטומי נתרן n אורביטלים, ו-n אלקטרונים, המסתדרים בשני סוגים של פסים : | ||
| + | |||
| + | [[Image:Metal1.JPG]] | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <u>הסבר לתמונה:</u> | ||
| + | |||
| + | בנתרן כל אחד מהאטומים תורם אורביטל ערכיות אחד (אורביטל 3s) ואלקטרון ערכיות אחד. אם ישנם בדגימה n אטומים, אזי אורביטלי 3s מתמזגים ויוצרים פס של n אורביטלים מולקולריים, מחציתם קושרים נטו, ומחציתם אנטיקושרים נטו. | ||
| + | |||
| + | אורביטל הוא קושר או אנטיקושר נטו משום שאורביטלים מולקולריים עשויים להיות קושרים בין שכנים מסוימים ואנטיקושרים בין שכנים אחרים. | ||
| + | |||
| + | מכיוון שכל אחד מn האטומים תורם אלקטרון ערכיות אחד, על n אלקטרונים למצוא מקומם בתוך האורביטלים השונים. האלקטרונים מאכלסים את האורביטלים בהתאם לעקרון הבנייה. מכיוון שבכל אורביטל יכולים להיות עד שני אלקטרונים, n האלקטרונים מאכלסים מחצית מהאורביטלים, את אלה בעלי האנרגיה הנמוכה יותר. | ||
| + | |||
| + | פס של אורביטלים מולקולריים ריקים, בעל אנרגיה גבוהה יותר ייקרא בשם "'''פס הולכה'''". | ||
| + | |||
| + | מכיוון שלאורביטלים השכנים יש אנרגיות קרובות, נדרשת השקעת אנרגיה קטנה בלבד כדי להעביר אלקטרונים בין האורביטלים השונים בפסי ההולכה, שהאנרגיה שלהם גבוהה רק במעט. | ||
| + | |||
| + | אלקטרונים אלה יכולים לנוע באין מפריע ברחבי המוצק, ולהעביר זרם חשמלי. | ||
| + | |||
| + | <br> | ||
| + | |||
| + | התנגדות המתכת עולה עולה עם הטמפרטורה, כיוון שחימום מגביר את תנודות האטומים. | ||
| + | |||
| + | האלקטרונים מתנגשים באטומים המתנודנדים ותנועתם החופשית דרך המוצק מופרעת. | ||
= העשרה - יוני מתכת ומתכות בחימצון חיזור = | = העשרה - יוני מתכת ומתכות בחימצון חיזור = | ||
= היבטים פדגוגיים = | = היבטים פדגוגיים = | ||
| + | |||
| + | המושג המקובל שמתמשים בו בספר "יחסים וקשרים", כאשר מדברים על מבנה החומר המתכתי הוא, לדעתנו, מושג שיכול להטעות את התלמידים - "יונים חיוביים". התלמידים מגיעים לנושא זה לאחר שלמדו את נושא הקשר היוני, ועלולים למשוך עמם את ההבנה של הקשר היוני לקשר המתכתי גם כן. היות ונושאים אלה שונים לחלוטין, אנו חושבים כי כדאי להתייחס למבנה כבעל "גלעינים", על מנת לא ליצור תפיסה מוטעית אצל התלמיד. | ||
| + | |||
| + | כמו כן, אנו רואים כ"יונים" חלקיקים נפרדים של חומר, ולא חלק ממבנה סריגי של מתכת. | ||
| + | |||
| + | |||
| + | |||
| + | נחום ואנה | ||
= קישורים חיצוניים = | = קישורים חיצוניים = | ||
[http://www.drkstreet.com/resources/metallic-bonding-animation.swf קישור לאנימציה של חומר מתכתי] | [http://www.drkstreet.com/resources/metallic-bonding-animation.swf קישור לאנימציה של חומר מתכתי] | ||
גרסה אחרונה מתאריך 21:07, 15 באוגוסט 2013
תוכן עניינים
הגדרה
היסודות הנמצאים מצדו השמאלי מקו המדרגות המפריד בטבלה המחזורית יוצרים קשרים מיוחדים, המבוססים על מודל הקשר המתכתי. מודל זה ניתן להסביר בפשטות כמודל "ים האלקטרונים", הרואה את המתכת כמורכבת מגלעינים חיוביים (גלעין הוא חלקיק, המכיל את גרעין האטום ואת האלקטרונים ברמות האנרגיה הפנימיות - ללא אלקטרוני ערכיות), הנמצאים בתוך רצף של אלקטרונים.
מבנה זה מאפשר להסביר את תכונות החומרים המתכתיים.
ניתן גם להסביר את המבנה המתכתי בעזרת תאוריית הקוונטים.
(העשרה)
תכונות חומרים מתכתיים
1. הולכת זרם חשמלי
2. הולכת חום
3. ברק אופייני
4. ריקוע של מתכות
מודל הקשר המתכתי
המודל הקלאסי
נוצר סוג של סריג, בעל יכולת להעביר אלקטרונים (הולכה חשמלית) , היות ואינם מחבורים באופן מלא לגלעין מסויים.
הקשר הוא קשר שיתופי.
המודל הקוונטי
המודל הקוונטי מאפשר להסביר את תכונות ההולכה אף יותר לעומק.
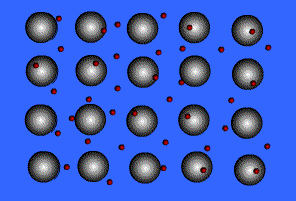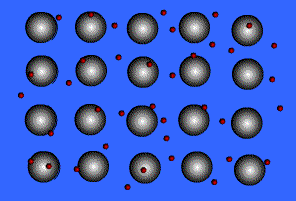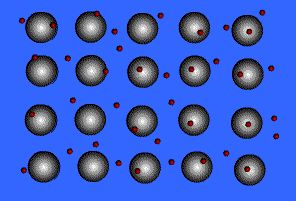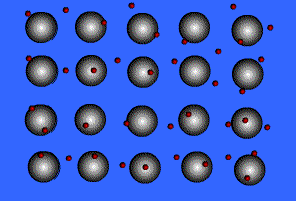
במתכת נוצרים מעין "פסי הולכה" של אורביטלים קושרים ובלתי קושרים, ברצף מסויים.
לדוגמא, בנתרן, כל אטום נתרן תורם אורביטל s3 אחד ואלקטרון אחד למבנה הפסים.
כך נוצרים מ-n אטומי נתרן n אורביטלים, ו-n אלקטרונים, המסתדרים בשני סוגים של פסים :
הסבר לתמונה:
בנתרן כל אחד מהאטומים תורם אורביטל ערכיות אחד (אורביטל 3s) ואלקטרון ערכיות אחד. אם ישנם בדגימה n אטומים, אזי אורביטלי 3s מתמזגים ויוצרים פס של n אורביטלים מולקולריים, מחציתם קושרים נטו, ומחציתם אנטיקושרים נטו.
אורביטל הוא קושר או אנטיקושר נטו משום שאורביטלים מולקולריים עשויים להיות קושרים בין שכנים מסוימים ואנטיקושרים בין שכנים אחרים.
מכיוון שכל אחד מn האטומים תורם אלקטרון ערכיות אחד, על n אלקטרונים למצוא מקומם בתוך האורביטלים השונים. האלקטרונים מאכלסים את האורביטלים בהתאם לעקרון הבנייה. מכיוון שבכל אורביטל יכולים להיות עד שני אלקטרונים, n האלקטרונים מאכלסים מחצית מהאורביטלים, את אלה בעלי האנרגיה הנמוכה יותר.
פס של אורביטלים מולקולריים ריקים, בעל אנרגיה גבוהה יותר ייקרא בשם "פס הולכה".
מכיוון שלאורביטלים השכנים יש אנרגיות קרובות, נדרשת השקעת אנרגיה קטנה בלבד כדי להעביר אלקטרונים בין האורביטלים השונים בפסי ההולכה, שהאנרגיה שלהם גבוהה רק במעט.
אלקטרונים אלה יכולים לנוע באין מפריע ברחבי המוצק, ולהעביר זרם חשמלי.
התנגדות המתכת עולה עולה עם הטמפרטורה, כיוון שחימום מגביר את תנודות האטומים.
האלקטרונים מתנגשים באטומים המתנודנדים ותנועתם החופשית דרך המוצק מופרעת.
העשרה - יוני מתכת ומתכות בחימצון חיזור
היבטים פדגוגיים
המושג המקובל שמתמשים בו בספר "יחסים וקשרים", כאשר מדברים על מבנה החומר המתכתי הוא, לדעתנו, מושג שיכול להטעות את התלמידים - "יונים חיוביים". התלמידים מגיעים לנושא זה לאחר שלמדו את נושא הקשר היוני, ועלולים למשוך עמם את ההבנה של הקשר היוני לקשר המתכתי גם כן. היות ונושאים אלה שונים לחלוטין, אנו חושבים כי כדאי להתייחס למבנה כבעל "גלעינים", על מנת לא ליצור תפיסה מוטעית אצל התלמיד.
כמו כן, אנו רואים כ"יונים" חלקיקים נפרדים של חומר, ולא חלק ממבנה סריגי של מתכת.
נחום ואנה