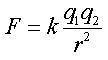קשרים בין מולקולריים
חומר בצובר מורכב ממספרים עצומים של חלקיקים : אטומים , מולקולות , יונים ( שם כולל - צורונים ) . הצורונים השונים ( בגודלם , בצורותם ובקוטביות שלהם ) נמצאים בצובר באינטראקציות שונות . לאינטראקציות בין הצורונים בצובר נהוג לקרוא כוחות בין-מולקולריים ( intermolecular forces ) - הכוחות הפועלים בין המולקולות , להבדיל מהכוחות האחראים להיווצרות קשרים כימיים בין האטומים - הקשרים הכימיים הנובעים מהכוחות התוך-מולקולריים ( intramolecular forces ) . הכוחות הבין-מולקולריים קושרים את הצורונים זה לזה בצובר והם בעלי חשיבות מכרעת בקביעת התכונות הפיזיקליות של חומר בצובר , לכן השם הנוסף של הכוחות הבין-מולקולריים הוא קשרים בין-מולקולריים .
הערה :
חומר בצובר ( bulk matter ) - כמות מסוימת של חומר שתכונותיו נובעות מתכונות הצורונים , המרכיבים את כל אחד ממצבי צבירה של החומר ( מוצק , נוזל , גז ) .
תוכן עניינים
סוגי הקשרים הבין-מולקולריים
קיימים הקשרים הבין-מולקולרים השונים :
1. קשרי ואן דר ואלס :
- כוחות לונדון - בין מולקולות לא קוטביות . - כוחות בין מולקולות לא קוטביות לבין מולקולות קוטביות , - כוחות בין מולקולות קוטביות .
2. קשרי מימן .
3. קשרים בין יונים לבין מולקולות קוטביות .
הערה:
במספר ספרי עיון "כימיה" מתייחסים לכוחות לונדון בלבד בשם "כוחות ואן דר ואלס" ומבדילים בשלוש סוגי האינטראקציות השונות , הקיימות זו לצד זו . לכל אחד מהאינטראקציות מתאימה אנרגיה פוטנציאלית טיפוסית כ- kj/mol 2 . בבית הספר אנו מתייחסים לקשרי ואן דר ואלס כלקשר מסוג אחד , המוגבר על ידי גורמים שונים ולא תמיד זה נכון!
נתן להסביר את מקור הקשרים הבין-מולקולריים השונים על פי חוק קולון , המתאר את את האינטראקציות בין הצורונים השונים .
כל הצורונים נמשכים זה לזה כשהן במרחק של כמה רדיאוסים מולקולריים , אך דוחים זה את זה מייד כאשר ענני האלקטרוניים שלהם באים במגע. כתוצאה , משתנה האנרגיה הפוטנציאלית של הצורון כתלות במרחק מהצורון האחר . במרחקים בינוניים האנרגיה הפוטנציאלית נמוכה מאשר במרחק אינסופי. משיכה מורידה תמיד את האנרגיה הפוטנציאלית של הצורונים. כאשר נוצר מגע בין הצורונים האנרגיה הפוטנציאלית מתחילה לעלות , שכן דחייה מעלה תמיד את האנרגיה הפוטנציאלית של הצורונים . כאשר על הצורונים לא פועלים כוחות נוספים , כוחות המשיכה והדחייה בין הצורונים משתווים וכתוצאה הצורונים נצמדים זה לזה במרחק מסוים - נוצרו הקשרים הבין- מולקולריים .
בין אלו הצורונים עשויות להתקיים האינטראקציות השונות ?
כל האינטראקציות בין הצורונים הן אינטראקציות קולוניות בין שני מטענים . הצורונים שונים זה מזה בקוטביות שלהם , לכן נוצרים סוגים שונים של האינטראקציות :
סוגי האינטראקציות :
1. אינטראקציות דיפול מושרה - דיפול מושרה : הצורונים המעורבים - כל סוגי המולקולות .
2. אינטראקציות דיפול - דיפול מושרה : הצורונים המעורבים - אחת המולקולות לפחות צריכה להיות קוטבית .
3. אינטראקציות דיפול - דיפול : הצורונים המעורבים - מולקולות קוטביות נייחות או מסתחררות ( בגז ) .
4. קשרי מימן : הצורונים המעורבים - מולקולות המכילות אטום מימן הקשור בקשר קוולנטי לאטום N , O , F .
5. אינטראקציות יון - דיפול : הצורונים המעורבים - יונים ומולקולות קוטביות .
הערה:
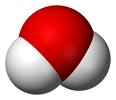
מולקולת מים היא דוגמה לצורון , המשתתף בכול סוגי האינטראקציות מ- 1 עד 5 .
דיפול - דו-קוטב קבוע , דיפול מושרה - דו-קוטב רגעי .
מאפייני האינטראקציה
האינטראקציות בין הצורונים גורמות לעוות האורביטלים המולקולריים של הצורונים , לשינוי חופש תנועתם , לשינוי האנרגיה הפוטנציאלית של הצורונים ולשינוי המרחק בין מרכזי הצורונים . המאפיינים , האנרגיה הפוטנציאלית והמרחק בין הצורונים , נתנים למדידה וחישובים כמותיים והם הבסים לסיווג הקשרים הבין מולקולריים . להשוואה של חוזק הקשרים הבין-מולקולריים , הבאה על ידי ביטוי בתכונות פיזיקליות של חומרים שונים ( טמפרטורת ההתוך , טמפרטורת הרתיחה , מצב צבירה בטמפרטורת החדר , צמיגות ... ), משתמשים במושג "אנרגיה פוטנציאלית" של הקשרים הבין-מולקולריים. אנרגיה פוטנציאלית של הקשרים הבין-מולקולרים היא האנרגיה הנדרשת לפירוק מול אחד של הקשרים הבין-מולקולריים בין הצורונים. מסמנים בסימן Ep ומחשבים ביחידות kj/mol . הביטוי לחישוב האנרגיה הפוטנציאלית דומה לביטוי לחישוב כוחות המשיכה והדחיה לפי חוק קולון.
גורמים , הנמצאים בביטוי הם גם דומים:
1. האנרגיה הפוטנציאלית של הקשרים הבין-מולקולרים נמצאת בקשר ישר למקפלה בין שני המטענים של הצורונים ( שלמים או חלקיים ) - סימנים של המטענים הם בהתאם לסוגי האינטראקציות השונות.
2. האנרגיה הפוטנציאלית של הקשרים הבין-מולקולרים נמצאת ביחס הפוך למרחק בין הצורונים בחזקות שונות בהתאם לסוגי האינטראקציות השונות.
הערה: בספרי עיון אינם משתמשים במושג "אורך הקשר" . אפשר להגדיר את אורך הקשר הבין-מולקולרי כמרחק בין שני המרכזים של הצורונים בצובר בפאזה מעובה ( נוזל או מוצק ), בו כוחות המשיכה והדחיה בין הצורונים שווים זה לזה ביחידות ננומטר nm . אורך הקשר הבין-מולקולרי גדול יותר מאורך הקשר הקוולנטי ולאינטראקציות השונות הוא בין 0.3 עד 1.0 nm . לדוגמה מולקולות של חמצן נמשכות זו לזו עד למרחק 0.4 nm . אנליזה ספקטרופוטומטרית מראה שבגזים שונים בתנאים שונים קיימים דימרים - מולקולות כפולות ( בטמפרטורות נמוכות ) .
סיווג הקשרים הבין-מולקולריים
נתן לסווג את הקשרים הבין-מולקולריים לפי חוזק הקשרים בהתאם לאנריה הפוטנציאלית של הקשרים הבין-מולקולריים.
קשרי ואן דר ואלס
אינטראקציות דיפול מושרה - דיפול מושרה
מולקולות לא קוטביות נמשכות זה לזה . תרכובות הפחמן רבות , הבנויות ממולקולות לא קוטביות הן במצב נוזל . אפשר לנזל גזים אצילים וגם חמצן . למולקולה לא קוטבית יכול להיות מומנט דיפול חולף , רגעי , והוא עשוי לעוות את ענן האלקטרונים של מולקולה שכנה ולחולל גם בה מומנט דיפול . שני הדיפולים מושכים זה את זה . המולקולה עם ענן האלקטרונים המעוות משפיעה על מולקולות סמוכות ולפי כך בין המולקולות קיימת משיכה . אינטראקציית לונדון היא אוניברסלית, אינה תלויה בזהותה הכימית של המולקולה והיא היחידה , הפועלת בין מולקולות לא קוטביות . אינטראקציה זו מתווספת לאינטראקציה דיפול - דיפול והיא בעלת האנרגיה הטיפוסית כ-2 kj/mol .
גורמים:
1. מטענים : חוזקה של אינטראקציית לונדון תלוי בכושר ההתקטבות ( מטענים אלפא ) של המולקולות - מידת העיוות של ענן האלקטרונים שלהן . למולקולות גדולות ובעלות אלקטרונים רבים כושר ההתכתבות גדול יותר .
2. מרחק : האנרגיה הפוטנציאלית היא יחסית לאחד חלקי החזקה השישית של המרחק בין שתי המולקולות. מאחר שחוזק האינטראקציה מושפעה מאוד מן המרחק בין המולקולות , צורת המולקולה ( שטח הפנים ) משפיעה גם : במולקולות בעלות צורות כדוריות יותר רק קטעים קטנים באים במגע ומטענים רגעים מרוחקים יותר .
אינטראקציות דיפול - דיפול מושרה
האינטראקציה דומה לאינטראקציית לונדון . דוגמה - חמצן מתמוסס במים . האינטראקציה נובעת מיכולת של מולקולה קוטבית להשרות מומנט דיפול במולקולה לא קוטבית . אנרגיה הטיפוסית של האינטראקציה גם כ- 2 kj/mol .
גורמים:
1. מטענים : כושר ההטקטבות ( אלפא ) ומטען חלקי של דיפול קבוע בחזקה שתיים ( מיו ).ככל שהמולקולות בעלות אלקטרונים רבים יותר וככל שהמטענים החלקיים של הדיפולים הקבועים גדולים יותר גם האינטראקציות החזקות יותר .
2. מרחק : השפעתו זהה לאינטראקציות לונדון.
אינטראקציות דיפול - דיפול
מולקולות קוטביות מעורבות באינטראקציות דיפול - דיפול - משיכה בין המטעניהן החלקיים של המולקולות . הן דועכות במהירות עם המרחק , בייחוד בפאזה הנוזלית ובפאזה הגזית , שבהן המולקולות מסתחררות סביב צירן . כאשר המולקולות הקוטביות קבועות במקומן במצב מוצק קיימת משיכה בין המטען החלקי השלילי של המולקולה האחת לבין המטען החלקי החיובי של המולקולה השכנה ולהפך המטענים החלקיים הזהים דוחים זה את זה והמולקולות נערכות בשורות במידת האפשר , כאשר המטענים החלקיים המנוגדים של המולקולות השכנות הם קרובים זה לזה . גם האינטראקצייה דיפול - דיפול היא אוניברסלית ואינה תלויה בזהותה הכימית של המולקולה . האנרגיות הטיפוסיות של האינטראקציה כ- 2 kj/mol בפאזה המוצקה או הנוזלית , כ-0.3 kj/mol בפאזה הגזית .
גורמים :
1. מטענים : ארבעת המטענים החלקיים של שתי המולקולות גורמים להיווצצרות של מומנטי הדיפולים של שתי המולקולות . ככל שמולקולות קוטביות יותר האינטראקציות החזקות יותר.
2. מרחק : מחקרים מראים כי האנרגיה הפוטנציאלית היא יחסית לאחד חלקי החזקה השלישית של המרחק בין המולקולות במצב מוצק או נוזל ויחסית לאחד חלקי החזקה השישית של המרחק בין המולקולות הקוטביות המסתחררות בפאזה הגזית .
קשרים בין יונים לבין מולקולות קוטביות
האינטראקציה האופיינית ליונים המומסים בממסים קוטביים ( מים , אתאנול , אמוניה נוזלית ) .האנרגיה הטיפוסית של האינטראקציה כ- 15 kj/mol .
גורמים :
1. מטענים : המטען השלם של יון ( זטא ) ומומנט דיפול ( מיו ) - המטען החלקי שבקצה אחד של המולקולה . האינטראקציה חזקה ביותר בין יונים קטנים בעלי מטען גדול לבין מולקולות קוטביות מאוד.
2.מרחק : האנרגיה תלויה במידה רבה במרחק בין המולקולה לבין היון . המולקולה הקוטבית צריכה להיות קרובה מאוד ליון ( כמעט לגעת ביון ) . ככל שהמולקולות הקוטביות הן קטנות יותר תתקיים בינהם האינטראקציה החזקה יותר .
הערה :
בכיתה לא מתיחסים לאינטראקציה יון - דיפול כלקשר הבין-מולקולרי , אלא כלקשר האלקטרוסטטי החדש שנוצר ... דוגמאות לאינטראקציות החזקות מסוג זה היא קיום הידרטים וגם היווצרות של היונים הממוימים בתהליך ההמסה במים של תרכובות יוניות .
קשרי מימן
האינטראקציה "קשרי מימן" היא ייחודית למולקולות מסוגים מסוימים . קשר המימן היא משיכה בין-מולקולרית חזקה , שבה אטום מימן נמצא בין שני אטומים קטנים בעלי אלקטרושליליות חזקה וזוגות אלקטרונים לא קושרים , בייחוד N , O , F . אחת המולקולות כוללת קשר קוולנטי קוטבי מאוד O-H , N-H , F-H , המספקת את האטום ה-H בעל המטען החיובי החלקי גדול מאוד , והאחרת כוללת אטום O , N , F בעל זוג אלקטרונים לא קושר. מכיוון שאטום המימן , בעל מטען חלקי חיובי גדול ובעל נפח קטן כל-כך , הוא נמשך לזוגות האלקטרונים לא קושרים ויכול להיתקרב קרוב מאוד לאחד הזוגות האלקטרונים הלא קושרים על אטומי O , N , F במולקולה שכנה . קשר המימן הוא קשר כיווני והחזק ביותר הוא כאשר אטום המימן נמצא על כו דמיוני ישר , המחבר בין שני אטומים בעלי האלקטרושליליות גדולה . כאשר הוא יכול להיווצר , קשר מימן הוא כה חזק - כ-10% מחוזקו של קשר קוולנטי טיפוסי . האנרגיה הטיפוסית של האינטראקציה היא כ-20 kj/mol . הדרך המקובלת לסמן קשר המימן היא באמצעות שורת נקודות :
O-H...O , F-H...F , N-H...N
גורמים:
1. מטענים : המטען החלקי השלילי על האטום האלקטרושלילי מאוד במולקולה האחת והמטען החלקי החיובי על המימן במולקולה הסמוכה . ככל שאלקטרושליליות של האטום , הנמצא בקשר המימן גדול יותר כך המטען החלקי השלילי גורם להיווצרות קשרי המימן החזקים יותר .
2. מרחק: המרחק , בו האטומים , המשתתפים ביצירת קשר המימן , נמצאים על כו ישר .
3.ריבוי קשרי המימן : מספר אטומי H , בעלי המטען החלקי החיבי בקשרים הקוטביים מאוד עלפני המולקולה האחת . אפשר לציין גם מספר זוגות האלקטרונים הלא קושרים . היחס הוא H אחד לזוג אחד של האלקטרונים הלא קושרים .
הצעות לניסויים
הניסוי "הכנת נרות לחנוכה" הוא ניסוי חוויתי .דרכו ניתן לחזק את ידיעות התלמידים בנושאים רבים ומגוונים ,כגון:תהליכי היתוך והמסה,קשרים בין-מולקולריים,יסודות החקר(רישום תצפיות ותוצאות,ניסוח שאלת חקר,ניתוח תוצאות והסקת מסקנות).
הניסוי מתקשר לנושא קשרים בין מולקולריים ומתאים לביצוע לאחר הוראת הנושא . בנוסף הניסוי מתקשר למושג צפיפות ( משקל סגולי) .
ניסוי "הכנת קרם ידיים" הוא הניסוי ברמה 1.מטרות הניסוי הן להעמיק ולחזק את ידיעות התלמיד בפרק "מבנה וקישור" ובעיקר בעניין החומרים המולקולריים,מבנה ותכונותיהם.הניסוי ניתן לביצוע גם בתנאי בית-הספר וגם במסגרת הפעילות "כימיה בחיי יום-יום" במכון דוידסון למדע.
הצעות לתירגול
בהכנה
דף עבודה בנושא "קשרים בין מולקולריים"
בדף ישנן מספר שאלות לתרגול בנושא "קשרים בין מולקולריים"
פעילות בנושא "קשרים בין מולקולריים"
הפעילות מכילה מספר שאלות בהן משתמשים במיומנות השוואה.
קישורים חיצוניים
לבחור : פעילויות ממוחשבות : מבנה וקישרים ותמיסות כותרת הקישור לתצוגה
קישור לאתר המלווה ספר "יחסים וקשרים בעלם החומרים"
אנימציה "היווצרות קשרי מימן"
אנימציה "היווצרות יונים ממוימים"
אנימציה "היווצרות דו-קטבים רגעים"