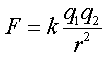קשרים בין מולקולריים
חומר בצובר מורכב ממספרים עצומים של חלקיקים : אטומים , מולקולות , יונים ( שם כולל - צורונים ) . הצורונים השונים ( בגודלם , בצורותם ובקוטביות שלהם ) נמצאים בצובר באינטראקציות שונות . לאינטראקציות בין הצורונים בצובר נהוג לקרוא כוחות בין-מולקולריים ( intermolecular forces ) - הכוחות הפועלים בין המולקולות , להבדיל מהכוחות האחראים להיווצרות קשרים כימיים בין האטומים - הקשרים הכימיים הנובעים מהכוחות התוך-מולקולריים ( intramolecular forces ) . הכוחות הבין-מולקולריים קושרים את הצורונים זה לזה בצובר והם בעלי חשיבות מכרעת בקביעת התכונות הפיזיקליות של חומר בצובר , לכן השם הנוסף של הכוחות הבין-מולקולריים הוא קשרים בין-מולקולריים .
הערה :
חומר בצובר ( bulk matter ) - כמות מסוימת של חומר שתכונותיו נובעות מתכונות הצורונים , המרכיבים את כל אחד ממצבי צבירה של החומר ( מוצק , נוזל , גז ) .
תוכן עניינים
סוגי הקשרים הבין-מולקולריים
קיימים הקשרים הבין-מולקולרים השונים :
1. קשרי ואן דר ואלס :
- כוחות לונדון - בין מולקולות לא קוטביות . - כוחות בין מולקולות לא קוטביות לבין מולקולות קוטביות , - כוחות בין מולקולות קוטביות .
2. קשרי מימן .
3. קשרים בין יונים לבין מולקולות קוטביות .
הערה:
במספר ספרי עיון "כימיה" מתייחסים לכוחות לונדון בלבד בשם "כוחות ואן דר ואלס" ומבדילים בשלוש סוגי האינטראקציות השונות , הקיימות זו לצד זו . לכל אחד מהאינטראקציות מתאימה אנרגיה פוטנציאלית טיפוסית כ- kj/mol 2 . בבית הספר אנו מתייחסים לקשרי ואן דר ואלס כלקשר מסוג אחד , המוגבר על ידי גורמים שונים ולא תמיד זה נכון!
נתן להסביר את מקור הקשרים הבין-מולקולריים השונים על פי חוק קולון , המתאר את את האינטראקציות בין הצורונים השונים .
כל הצורונים נמשכים זה לזה כשהן במרחק של כמה רדיאוסים מולקולריים , אך דוחים זה את זה מייד כאשר ענני האלקטרוניים שלהם באים במגע. כתוצאה , משתנה האנרגיה הפוטנציאלית של הצורון כתלות במרחק מהצורון האחר . במרחקים בינוניים האנרגיה הפוטנציאלית נמוכה מאשר במרחק אינסופי. משיכה מורידה תמיד את האנרגיה הפוטנציאלית של הצורונים. כאשר נוצר מגע בין הצורונים האנרגיה הפוטנציאלית מתחילה לעלות , שכן דחייה מעלה תמיד את האנרגיה הפוטנציאלית של הצורונים . כאשר על הצורונים לא פועלים כוחות נוספים , כוחות המשיכה והדחייה בין הצורונים משתווים וכתוצאה הצורונים נצמדים זה לזה במרחק מסוים - נוצרו הקשרים הבין- מולקולריים .
בין אלו הצורונים עשויות להתקיים האינטראקציות השונות ?
כל האינטראקציות בין הצורונים הן אינטראקציות קולוניות בין שני מטענים . הצורונים שונים זה מזה בקוטביות שלהם , לכן נוצרים סוגים שונים של האינטראקציות :
סוגי האינטראקציות :
1. אינטראקציות דיפול מושרה - דיפול מושרה : הצורונים המעורבים - כל סוגי המולקולות .
2. אינטראקציות דיפול - דיפול מושרה : הצורונים המעורבים - אחת המולקולות לפחות צריכה להיות קוטבית .
3. אינטראקציות דיפול - דיפול : הצורונים המעורבים - מולקולות קוטביות נייחות או מסתחררות ( בגז ) .
4. קשרי מימן : הצורונים המעורבים - מולקולות המכילות אטום מימן הקשור בקשר קוולנטי לאטום N , O , F .
5. אינטראקציות יון - דיפול : הצורונים המעורבים - יונים ומולקולות קוטביות .
הערה:
מולקולת מים היא דוגמה לצורון , המשתתף בכול סוגי האינטראקציות מ- 1 עד 5 .
דיפול - דו-קוטב קבוע , דיפול מושרה - דו-קוטב רגעי .
מאפייני האינטראקציה
האינטראקציות בין הצורונים גורמות לעוות האורביטלים המולקולריים של הצורונים , לשינוי חופש תנועתם , לשינוי האנרגיה הפוטנציאלית של הצורונים ולשינוי המרחק בין מרכזי הצורונים . המאפיינים , האנרגיה הפוטנציאלית והמרחק בין הצורונים , נתנים למדידה וחישובים כמותיים והם הבסים לסיווג הקשרים הבין מולקולריים . להשוואה של חוזק הקשרים הבין-מולקולריים , הבאה על ידי ביטוי בתכונות פיזיקליות של חומרים שונים ( טמפרטורת ההתוך , טמפרטורת הרתיחה , מצב צבירה בטמפרטורת החדר , צמיגות ... ), משתמשים במושג "אנרגיה פוטנציאלית" של הקשרים הבין-מולקולריים. אנרגיה פוטנציאלית של הקשרים הבין-מולקולרים היא האנרגיה הנדרשת לפירוק מול אחד של הקשרים הבין-מולקולריים בין הצורונים. מסמנים בסימן Ep ומחשבים ביחידות kj/mol . הביטוי לחישוב האנרגיה הפוטנציאלית דומה לביטוי לחישוב כוחות המשיכה והדחיה לפי חוק קולון.
גורמים , הנמצאים בביטוי הם גם דומים:
1. האנרגיה הפוטנציאלית של הקשרים הבין-מולקולרים נמצאת בקשר ישר למקפלה בין שני המטענים של הצורונים ( שלמים או חלקיים ) - סימנים של המטענים הם בהתאם לסוגי האינטראקציות השונות.
2. האנרגיה הפוטנציאלית של הקשרים הבין-מולקולרים נמצאת ביחס הפוך למרחק בין הצורונים בחזקות שונות בהתאם לסוגי האינטראקציות השונות.
הערה: בספרי עיון אינם משתמשים במושג "אורך הקשר" . אפשר להגדיר את אורך הקשר הבין-מולקולרי כמרחק בין שני המרכזים של הצורונים בצובר בפאזה מעובה ( נוזל או מוצק ), בו כוחות המשיכה והדחיה בין הצורונים שווים זה לזה ביחידות ננומטר nm . אורך הקשר הבין-מולקולרי גדול יותר מאורך הקשר הקוולנטי ולאינטראקציות השונות הוא בין 0.3 עד 1.0 nm . לדוגמה מולקולות של חמצן נמשכות זו לזו עד למרחק 0.4 nm . אנליזה ספקטרופוטומטרית מראה שבגזים שונים בתנאים שונים קיימים דימרים - מולקולות כפולות ( בטמפרטורות נמוכות ) .
סיווג הקשרים הבין-מולקולריים
קשריואן דר ואלס
אינטראקציות דיפול מושרה - דיפול מושרה
אינטראקציות דיפול - דיפול מושרה
אינטראקציות דיפול - דיפול
קשרי מימן
קשרים בין יונים לבין מולקולות קוטביות
הצעות לתירגול
קישורים חיצוניים