רמות אנרגיה
רמת אנרגיה היא כמות אנרגיה מוגדרת שיש לאלקטרון באטום.
המצב היציב של אלקטרון הוא כאשר האלקטרון נמצא במרחק מהגרעין התואם את רמת האנרגיה שיש לאלקטרון. במצב זה תנועתו של אלקטרון סביב הגרעין אינה מלווה בפליטת האנרגיה
- כל האלקטרונים באותה רמת אנרגיה הם בעלי כמות דומה של אנרגיה. ככל שלאלקטרון יש כמות אנרגיה נמוכה יותר, יש סיכוי גדול יותר שהוא יימצא קרוב לגרעין ,ולהיפך.
- הוספת/קליטת אנרגיה לאלקטרונים ע"י קרינה, חימום או זרם חשמלי גורמת לעירור כלומר למעבר של האלקטרון מרמת אנרגיה נמוכה לגבוהה. המצב המעורר הוא מצב לא יציב ולאחר זמן אלקטרון פולט אנרגיה וחוזר לרמת האנרגיה המקורית. חזרה של אלקטרון לרמת האנרגיה המקורית מלווה בפליטת מנה של אנרגיה הנקראת קוונט.
ככל שההפרש בין רמת האנרגיה אליה הגיעה האלקטרון המעורר לבין רמת האנרגיה המקורית שלו גדול יותר, כך תפלט כמות אנרגיה גדולה יותר
- האנרגיה שנפלטת/נקלטת במעבר האלקטרונים מרמת אנרגיה אחת לשניה היא מנתית (קוונטית) ולא רציפה, כלומר לא כל כמות אנרגיה מוספת תגרום לעירור, אלא רק כזו שתהיה כפולה של גודל מסויים.
אנלוגיה למדרגות : כדי לעלות במדרגה צריך להשקיע אנרגיה. אם אין מספיק אנרגיה לא נעלה מדרגה. אין ½ מדרגה. (בניגוד לקומות שאפשר להיתקע בין 2 קומות). הבעיה באנלוגיה שלא בהכרח שכל המדרגות בגודל שווה, כי לכל רמת אנרגיה יש את תכולת האנרגיה שלה.
- עירור האלקטרונים לרמות אנרגיה גבוהות יותר, סופו בחזרת האלקטרונים המעוררים לרמת האנרגיה המקורית, תוך כדי פליטת אנרגיה כיוון שזהו המצב היציב ביותר מבחינה אנרגתית (בגלל המשיכה בין האלקטרון לבין הגרעין). אולם, זה אינו שולל קיום של מצבים נוספים, פחות יציבים.
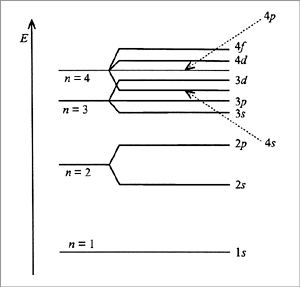
רמות אנרגיה באטום.
אלקטרונים באטום נמצאים במרחקים שונים מהגרעין - בעלי ברמות אנרגיה שונות.
ככל שהמרחק בין הגרעין לבין האלקטרון הוא גדול יותר, כך אלקטרון נמצא ברמת האנרגיה גבווה יותר כלומר יש לו כמות אנרגיה גדולה יותר.
אלקטרונים נעים על אורביטלים מוגדרים ,אורביטלי האלקטרונים עם אותה רמת אנרגיה יכולים להיות שונים בצורתם המרחבית .
מספר אלקטרונים בכל רמת האנרגיה שונה, ככל שהמרחק בין הגרעין לבין האלקטרונים גדול יותר, כך מספר האלקטרונים עם רמת האנרגיה זהה גדול יותר .
הודות לתכונות הגל לכל אלקטרון באטום יש ערך אנרגטי מוגדר והוא תלוי במרחק של אותו אלקטרון מהגרעין.
לאלקטרונים בעלי ערכים אנרגטיים דומים יש אותה רמת האנרגיה.מספר מקסימלי של אלקטרונים עם רמת האנרגיה זהה הוא 2n2
כל אלקטרון באטום מאופיין על ידי ארבעה מספרים קוונטיים:
מספר הראשי המציין את רמת האנרגיה של אלקטרון המושפעת מהמרחק של אלקטרון מהגרעין באטם
מספר אורביטלי המציין את הצורה המרחבית של האורביטל עליו נמצא האלקטרון
מספר קוונטי מגנטי המאפיין את המצב של האורביטל במרחב
מספר ספין המאפיין כיוון תנועת האלקטרון סביב ציר עצמי
באטום אין שני אלקטרונים להם כל ארבעת המספרים זהים(עיקרון פאולי)
איכלוס האורביטלים של רמות אנרגיה שונות מתבצע על פי כללים:
כלל פעולי: באטום אין שני אלקטרונים להם ארבעה מספרים קוונטים זהים - על כל אורביטל יכולים להיות רק שני אלקטרונים בעלי ספינים שונים.
כלל האנרגיה הנמוכה: כל אלקטרון ממוקם כך שאנרגיה שלו תהיהי מינימלית
כלל הונד: אטום במצב יציב יכיל מספר מקסימלי של אלקטרונים לא מזווגים
באיור ניתן לראות שינוי באנרגיה של אלקטרונים כתלות במרחק אלקטרון מגרעין האטום.