מבנה מרחבי של מולקולות
מתוך Restoeebs Wiki
תוכן עניינים
מודל דחיית זוגות האלקטרונים אלקטרונים
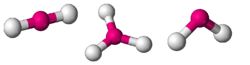
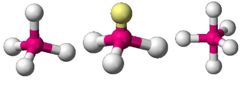
מודל הדחייה בין זוגות האלקטרונים ברמות הערכיות מרחיב את תיאורית הקשר של לואיס ומוסיף לה כללים המסבירים את זוויות הקשר, על מנת להסביר את צורות המולקולות. על פי המודל, איזורים שצפיפות האלקטרונים בהם גבוהה מתמקמים כך שהמרחקים ביניהם גדולים ככל האפשר; זוגות אלקטרונים בקשר מרובה נחשבים לצורך זה ליחידה אחת. מיקומיהם היחסיים של האטומים קובעים את צורת המולקולה. מבנה מרחבי של מים
צורות מישוריות:
מולקולות במבנה קווי
- מבנה חד ממדי
- האטום המרכזי יוצר קשר קוולנטי יחיד או כפול או שני קשרים.
- אין זוגות אלקטרונים לא קושרים על האטום המרכזי.
מולקולות במבנה זוויתי
- מבנה דו ממדי
- לאטום המרכזי קשורות שתי קבוצות אטומים, סביב האטום המרכזי נמצאים שני זוגות אלקטרונים לא קושרים.
צורות תלת מימדיות:
קישורים חיצוניים
אתר, המכיל מידע על מבנה מולקולות שונות (כולל אורכי קשר וזוויות), אינטראקטיבי: