שיחה:אנרגיה וקינטיקה
בהמשך לדיון שנערך בנושא שינוי האנרגיה הפנימית בהשוואה לשינוי האנתלפיה של תהליך.
כזכור אמרנו שכמות האנרגיה שעוברת בתהליך חימום (החום - Q) שווה לשינוי האנרגיה הפנימית כאשר תהליך מתרחש בנפח קבוע ולשינוי האנתלפיה כאשר הלחץ קבוע.
כדי עמוד על ההבדל בין השניים - דמיינו תהליך חימום בלחץ קבוע שמתרחש בשני שלבים (המע' מכילה גז אידיאלי):
1) מחממים את מערכת סגורה עם כמות חום Q ללא מתן אפשרות לשינוי הנפח. - הטמפרטורה תעלה מ- T1 ל- T2.
2) הלחץ במערכת יעלה בעקבות כך שהלחץ יעלה גם. (P ביחס ישר ל- T)
3) מסירים את ההגבלה על שינוי נפח - ומאפשרים השוואת לחצים עם החוץ בתהליך אדיאבטי (שבו אין מעבר חום). בעקבות כך הלחץ ירד, הנפח יעלה, האנרגיה הפנימית יורדת מאחר ובוצעה עבודת התפשטות - ולכן הטמפרטורה חייבת לרדת ל- T3.
אם נשווה את קיבול החום לשני התהליכים -
בתהליך החימום בנפח קבוע (
בתהליך החימום בלחץ קבוע - כמות החום זהה והפרש הטמפרטורות קטן יותר (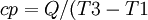
המשמעות היא שכמות אנרגיה זהה גורמת לשינוי טמפרטורה במידה שונה. או לחילופין שנדרשת השקעת אנרגיה גבוהה יותר עבור תהליך בלחץ קבוע - כדי ליצור את אותו שינוי טמפרטורה.
בתהליך חימום בלחץ קבוע חלק מהאנרגיה משמש לשינוי הטמפרטורה (העלאת האנרגיה הקינטית הממוצעת של החלקיקים) - זהו החלק ששווה לשיני האנתלפיה, וחלק אחר מועבר לסביבה כעבודת התפשטות - על מנת לשמור על הלחץ במערכת קבוע - ולכן סה"כ השינוי באנרגיה הפנימית גדול משינוי האנתלפיה.