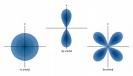
אורביטל
אורביטל- המרחב שבו יש סיכוי (95%) למצוא את האלקטרון במרחב האטום.
אלקטרונים באטום נמצאים ברמות אנרגיה שונות. כל רמת האנרגיה יכולה להכיל מספר אורביטלים שונים. על כל אורביטל יכולים לנוע שני אלקטרונים בעלי כיוני תנועה ( ספין)מנוגדים באטומים עם מספר גדול של רמות אנרגיה אלקטרונים מאכלסים קודם את האורביטל בעלת אנרגיה נמוכה ברמה גבוהה יותר ורק אחר כך אורביטלים ברמה נמוכה יותר. באיור ניתן לראות שלאורביטלים 3d אנרגיה גבוהה יותר מאורביטלים 4s ן-4p|.
ישנם מספר סוגי אורביטלים להם צורות מרחביות שונות: s,p,d,f
כדי לראות אורביטלים באטומים שונים כנס לקישור הבא:
אורביטלים באטומים של יסודות שונים
בניסוי דוויסון-גרמר הוכח שאלקטרון מתנהג כמו גל. הדמיה שמציגה את הניסוי:
[ניסוי http://phet.colorado.edu/simulations/sims.php?sim=DavissonGermer_Electron_Diffraction]
על פי עקרון האי-ודאות של הייזנברג אין לדעת בוודאות את מהירות תנועת האלקטרון ואת מיקומו בכל רגע נתון ולכן משתמשים במושג אורביטל המתאר את המקום האפשרי להמצאותו של אלקטרון במרחב.
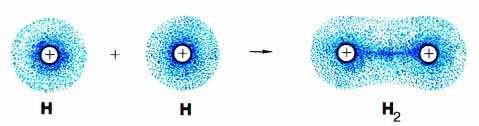
כאשר נוצר קשר קוולנטי בין שניים או יותר אטומים, יש חפיפה בין אורביטלים של אטומים המשתתפים ביצירת הקשר ונוצר אורביטל מולקולרי.
קשיים בהוראת הנושא: לתלמידים קשה להבין שאין מסלול בו נע האלקטרון או שהמסלול הוא דמיוני. ניתן לדמות את האורביטלים בתוך האטום לאורביטלים של כוכבים במערכת השמש ולשאול:"האם יש מסלול שבו נעים הכוכבם? " תלמידים יכולים להסביר כיצד נקבע מסלול התנועה של כוכב ובכך גם להבין מהו אורביטל של אלקטרון.
עזרי ההוראה: מצגת שבניתי עוזרת להסביר את הערכות האלקטרונים באטום לפי רמות אנרגיה וגם את המושג "אנרגיית יינון"
קישור למצגת: אכלוס אלקטרונים באטום ואנרגיית יינון