קשר קוולנטי: הבדלים בין גרסאות
| שורה 1: | שורה 1: | ||
= קשר קוולנטי = | = קשר קוולנטי = | ||
| + | |||
| + | '''קשר קוולנטי (קו=שיתוף,ולנטי=ערכי) קשר שנוצר משיתוף אלקטרונים ערכיים של 2 אטומים של יסודות אל-מתכתיים'''. | ||
| + | בעת התקרבות האטומים שיוצרים קשר קוולנטי, יש חפיפה של האורביטלים האטומיים שלהם ונוצר [[אורביטל מוקלקולרי]]. אורביטל כזה יאוכלס ע"י זוג אלקטרוני קשר. | ||
| + | |||
| + | האלקטרונים המשתתפים ביצירת קשר הקוולנטי הם האלקטרונים הערכיים הלא מזווגים של כל אטום (עפ"י נוסחאות לואיס של האטומים שיוצרים את הקשר). | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
קשר קוולנטי: מולקולה | קשר קוולנטי: מולקולה | ||
גרסה מתאריך 00:41, 13 בדצמבר 2009
קשר קוולנטי
קשר קוולנטי (קו=שיתוף,ולנטי=ערכי) קשר שנוצר משיתוף אלקטרונים ערכיים של 2 אטומים של יסודות אל-מתכתיים. בעת התקרבות האטומים שיוצרים קשר קוולנטי, יש חפיפה של האורביטלים האטומיים שלהם ונוצר אורביטל מוקלקולרי. אורביטל כזה יאוכלס ע"י זוג אלקטרוני קשר.
האלקטרונים המשתתפים ביצירת קשר הקוולנטי הם האלקטרונים הערכיים הלא מזווגים של כל אטום (עפ"י נוסחאות לואיס של האטומים שיוצרים את הקשר).
קשר קוולנטי: מולקולה
נוצר ע"י שיתוף אלקטרונים (ולא "מסירה") בין יסודות מקבוצת האל-מתכות ליצירת מולקולות. כל זוג אלקטרונים "משותפים" יוצרים קשר קוולנטי. סביב כל אטום במולקולה יהיה לרוב אוקטט – 8 אלקטרונים (מימן- שני אלקטרונים).
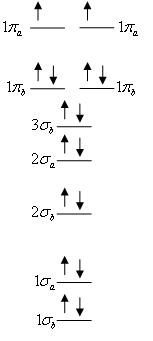
אורביטלים מולקולריים (במולקולות דו-אטומיות): על אותו עיקרון כמו אורביטלים אטומיים, ומקיימים את כללי פאולי והונד. קיימים שני סוגים: . לכל אחד מהם, בכל רמה אנרגטית קיים אורביטל "קושר" ואורביטל "לא-קושר", ובכל אורביטל מקום לשני אלקטרונים עם ספין הפוך. אורביטל קושר (bonding) – סיכוי גבוה למצוא אלקטרונים בין גרעיני שני האטומים. אורביטלים אלה תורמים למשיכה בין האטומים וליציבות המולקולה. לא-קושר (anti-bonding) – סיכוי גבוה למצוא את האלקטרונים בצד הנגדי של כל גרעין, וסיכוי נמוך למצוא אותם בין הגרעינים. אורביטלים אלה גורמים לדחייה בין האטומים ומפחיתים את יציבות המולקולה.
הצגה גרפית: מולקולת חמצן O2:
כמו אטום, מולקולה תהיה פארא- או דיא- מגנטית כתלות בקיום אלקטרונים לא מזווגים, וזאת בלי קשר לתכונות האטומים המרכיבים את המולקולה.
סדר הקשר: מספר זוגות האלקטרונים הנמצאים בין שני הגרעינים ותורמים למשיכה. במולקולות דו-אטומיות: . במולקולות פולי-אטומיות: לפי "אלקטרוני הערכיות". אלקטרוני הערכיות הם האלקטרונים ברמה האנרגטית n הגבוהה ביותר באטום. כל אטום יוצר קשרים קוולנטיים כך שהגרעין שלו מושך 8 אלקטרונים ברמה החיצונית ביותר – רמות s ו-p מלאות, כלומר מספר הקשרים שהוא יוצר (סדר הקשר): 8 פחות מספר אלקטרוני הערכיות. H יוצר קשר קוולנטי אחד, O שני קשרים קוולנטיים (בדר"כ), C ארבעה קשרים קוולנטיים (בדר"כ), N שלושה קשרים קוולנטיים בהרבה מולקולות, ההלוגנים- קשר קוולנטי אחד ( Fתמיד ושאר ההלוגנים- לרוב).
- בהשוואה בין מולקולות הבנויות מאטומים דומים בגודלם (מאותה שורה בטבלה המחזורית), ככל שעולה סדר הקשר צריך להשקיע יותר אנרגיה כדי לפרק את המולקולה.
קוטביות מולקולות: כאשר צד אחד של המולקולה בעל מטען חשמלי שונה מן הצד השני. הקוטביות נקבעת לפי ההבדלים בזיקה האלקטרונית בין האטומים – "הפרש האלקטרו-שליליות". ככל שההבדלים גדולים יותר כך יש יותר סיכוי למצוא את אלקטרוני הקשר בצד של האטום בעל הזיקה הגבוהה יותר.
אל-איתור: במולקולות מסוימות נוצרות טבעות של אטומים, והאלקטרונים שבצד הפנימי של הטבעת נמשכים באופן שווה לכל המולקולות המרכיבות אותה, כך שאי אפשר לומר שזוג מולקולות כלשהו יצר קשר מסדר מסוים.
- כאשר יש יותר מאטום חמצן אחד במולקולה (בנוסף לאטומים אחרים), אטומי החמצן אינם קשורים זה לזה.
- המולקולה בעלת מבנה מרחבי בו הדחייה בין אלקטרונים מינימלית (קווי, זוויתי, פירמידלי, טטראדרי).
- סך כל האלקטרונים במולקולה (הקושרים והלא-קושרים) שווה לסך אלקטרוני הערכיות של כל האטומים במולקולה.