קשר קוולנטי: הבדלים בין גרסאות
| שורה 1: | שורה 1: | ||
| − | = קשר קוולנטי = | + | = קשר קוולנטי = |
קשר קוולנטי: מולקולה | קשר קוולנטי: מולקולה | ||
| שורה 9: | שורה 9: | ||
אורביטלים מולקולריים (במולקולות דו-אטומיות): על אותו עיקרון כמו אורביטלים אטומיים, ומקיימים את כללי פאולי והונד. קיימים שני סוגים: . לכל אחד מהם, בכל רמה אנרגטית קיים אורביטל "קושר" ואורביטל "לא-קושר", ובכל אורביטל מקום לשני אלקטרונים עם ספין הפוך. אורביטל קושר (bonding) – סיכוי גבוה למצוא אלקטרונים בין גרעיני שני האטומים. אורביטלים אלה תורמים למשיכה בין האטומים וליציבות המולקולה. לא-קושר (anti-bonding) – סיכוי גבוה למצוא את האלקטרונים בצד הנגדי של כל גרעין, וסיכוי נמוך למצוא אותם בין הגרעינים. אורביטלים אלה גורמים לדחייה בין האטומים ומפחיתים את יציבות המולקולה. | אורביטלים מולקולריים (במולקולות דו-אטומיות): על אותו עיקרון כמו אורביטלים אטומיים, ומקיימים את כללי פאולי והונד. קיימים שני סוגים: . לכל אחד מהם, בכל רמה אנרגטית קיים אורביטל "קושר" ואורביטל "לא-קושר", ובכל אורביטל מקום לשני אלקטרונים עם ספין הפוך. אורביטל קושר (bonding) – סיכוי גבוה למצוא אלקטרונים בין גרעיני שני האטומים. אורביטלים אלה תורמים למשיכה בין האטומים וליציבות המולקולה. לא-קושר (anti-bonding) – סיכוי גבוה למצוא את האלקטרונים בצד הנגדי של כל גרעין, וסיכוי נמוך למצוא אותם בין הגרעינים. אורביטלים אלה גורמים לדחייה בין האטומים ומפחיתים את יציבות המולקולה. | ||
| − | |||
| − | |||
| − | + | [[Image:Sidur2.JPG]] | |
| − | |||
| + | הצגה גרפית: מולקולת חמצן O2: | ||
| + | <br> | ||
| + | [[Image:Tat ramot.JPG|Image:Tat_ramot.JPG]]<br> | ||
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
<br> | <br> | ||
| שורה 60: | שורה 64: | ||
|} | |} | ||
| − | | + | |
אל-איתור: במולקולות מסוימות נוצרות טבעות של אטומים, והאלקטרונים שבצד הפנימי של הטבעת נמשכים באופן שווה לכל המולקולות המרכיבות אותה, כך שאי אפשר לומר שזוג מולקולות כלשהו יצר קשר מסדר מסוים. | אל-איתור: במולקולות מסוימות נוצרות טבעות של אטומים, והאלקטרונים שבצד הפנימי של הטבעת נמשכים באופן שווה לכל המולקולות המרכיבות אותה, כך שאי אפשר לומר שזוג מולקולות כלשהו יצר קשר מסדר מסוים. | ||
גרסה מתאריך 15:27, 9 בדצמבר 2009
קשר קוולנטי
קשר קוולנטי: מולקולה
נוצר ע"י שיתוף אלקטרונים (ולא "מסירה") בין יסודות מקבוצת האל-מתכות ליצירת מולקולות. כל זוג אלקטרונים "משותפים" יוצרים קשר קוולנטי. סביב כל אטום במולקולה יהיה לרוב אוקטט – 8 אלקטרונים (מימן- שני אלקטרונים).
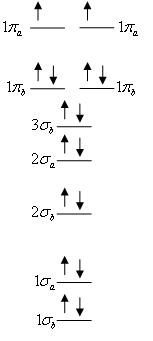
אורביטלים מולקולריים (במולקולות דו-אטומיות): על אותו עיקרון כמו אורביטלים אטומיים, ומקיימים את כללי פאולי והונד. קיימים שני סוגים: . לכל אחד מהם, בכל רמה אנרגטית קיים אורביטל "קושר" ואורביטל "לא-קושר", ובכל אורביטל מקום לשני אלקטרונים עם ספין הפוך. אורביטל קושר (bonding) – סיכוי גבוה למצוא אלקטרונים בין גרעיני שני האטומים. אורביטלים אלה תורמים למשיכה בין האטומים וליציבות המולקולה. לא-קושר (anti-bonding) – סיכוי גבוה למצוא את האלקטרונים בצד הנגדי של כל גרעין, וסיכוי נמוך למצוא אותם בין הגרעינים. אורביטלים אלה גורמים לדחייה בין האטומים ומפחיתים את יציבות המולקולה.
הצגה גרפית: מולקולת חמצן O2:
כמו אטום, מולקולה תהיה פארא- או דיא- מגנטית כתלות בקיום אלקטרונים לא מזווגים, וזאת בלי קשר לתכונות האטומים המרכיבים את המולקולה.
סדר הקשר: מספר זוגות האלקטרונים הנמצאים בין שני הגרעינים ותורמים למשיכה. במולקולות דו-אטומיות: . במולקולות פולי-אטומיות: לפי "אלקטרוני הערכיות". אלקטרוני הערכיות הם האלקטרונים ברמה האנרגטית n הגבוהה ביותר באטום. כל אטום יוצר קשרים קוולנטיים כך שהגרעין שלו מושך 8 אלקטרונים ברמה החיצונית ביותר – רמות s ו-p מלאות, כלומר מספר הקשרים שהוא יוצר (סדר הקשר): 8 פחות מספר אלקטרוני הערכיות. H יוצר קשר קוולנטי אחד, O שני קשרים קוולנטיים (בדר"כ), C ארבעה קשרים קוולנטיים (בדר"כ), N שלושה קשרים קוולנטיים בהרבה מולקולות, ההלוגנים- קשר קוולנטי אחד ( Fתמיד ושאר ההלוגנים- לרוב).
- בהשוואה בין מולקולות הבנויות מאטומים דומים בגודלם (מאותה שורה בטבלה המחזורית), ככל שעולה סדר הקשר צריך להשקיע יותר אנרגיה כדי לפרק את המולקולה.
קוטביות מולקולות: כאשר צד אחד של המולקולה בעל מטען חשמלי שונה מן הצד השני. הקוטביות נקבעת לפי ההבדלים בזיקה האלקטרונית בין האטומים – "הפרש האלקטרו-שליליות". ככל שההבדלים גדולים יותר כך יש יותר סיכוי למצוא את אלקטרוני הקשר בצד של האטום בעל הזיקה הגבוהה יותר.
אל-איתור: במולקולות מסוימות נוצרות טבעות של אטומים, והאלקטרונים שבצד הפנימי של הטבעת נמשכים באופן שווה לכל המולקולות המרכיבות אותה, כך שאי אפשר לומר שזוג מולקולות כלשהו יצר קשר מסדר מסוים.
- כאשר יש יותר מאטום חמצן אחד במולקולה (בנוסף לאטומים אחרים), אטומי החמצן אינם קשורים זה לזה.
- המולקולה בעלת מבנה מרחבי בו הדחייה בין אלקטרונים מינימלית (קווי, זוויתי, פירמידלי, טטראדרי).
- סך כל האלקטרונים במולקולה (הקושרים והלא-קושרים) שווה לסך אלקטרוני הערכיות של כל האטומים במולקולה.