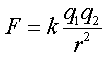אלקטרושליליות: הבדלים בין גרסאות
מתוך Restoeebs Wiki
| שורה 1: | שורה 1: | ||
| − | מבטא את הנטיה של אטומים שונים למשוך אלקטרונים. הערכים של האלקטרושליליות הם בין 0 ל- 4. ערך האלקטרושליליות גבוה, מציין נטייה גדולה יותר למשוך אלקטרונים. ניתן למצוא את ערכי האלקטרושליליות של כל יסוד בטבלה מתאימה | + | מבטא את הנטיה של אטומים שונים למשוך אלקטרונים. הערכים של האלקטרושליליות הם בין 0 ל- 4. ערך האלקטרושליליות גבוה, מציין נטייה גדולה יותר למשוך אלקטרונים. ניתן למצוא את ערכי האלקטרושליליות של כל [[יסוד]] בטבלה מתאימה |
| + | [http://en.wikipedia.org/wiki/Electronegativities_of_the_elements_(data_page)אתר שמציג ערכי אלקטרושליליות של יסודות] | ||
| − | |||
| − | |||
| − | |||
*כללי אצבע: | *כללי אצבע: | ||
| − | 1.מתכות הן בעלות אלקטרושליליות נמוכה משל אל-מתכות. | + | 1.[[מתכות]] הן בעלות אלקטרושליליות נמוכה משל [[אל-מתכות]]. |
2. לפלואור אלקטרושליליות הגבוהה ביותר. ככל שמתרחקים ממנו האלקטרושליליות יורדת. | 2. לפלואור אלקטרושליליות הגבוהה ביותר. ככל שמתרחקים ממנו האלקטרושליליות יורדת. | ||
| שורה 13: | שורה 11: | ||
3. למימן אלקטרושליליות הנמוכה מרב האל-מתכות. | 3. למימן אלקטרושליליות הנמוכה מרב האל-מתכות. | ||
| − | 4. אלקטרושליליות היא גודל שתלוי בין היתר | + | 4. אלקטרושליליות היא גודל שתלוי בין היתר ב[[אנרגיית ינון]] ,[[זיקה אלקטרונית]] ולכן מתנהגת כמוהם. לכן, ניתן לנבא למי תהיה אלקטרושליליות גבוהה יותר עפ"י המיקום בטבלה המחזורית (בדומה לאנרגיית יינון). |
* יש לזכור ערכי אלקטרושליליות של אטומים נבחרים כמו: פלואור(F): 4 , חמצן (O) 3.5, כלור(Cl), וחנקן(N)-3, פחמן(C) -2.5, מימן (H) – 2.1 . כאמור,המימן בעל האלקטרושליליות הנמוכה ביותר מבין כל האל מתכות. | * יש לזכור ערכי אלקטרושליליות של אטומים נבחרים כמו: פלואור(F): 4 , חמצן (O) 3.5, כלור(Cl), וחנקן(N)-3, פחמן(C) -2.5, מימן (H) – 2.1 . כאמור,המימן בעל האלקטרושליליות הנמוכה ביותר מבין כל האל מתכות. | ||
| + | |||
| + | |||
| + | [[תמונה:Coulombs law02.gif|left|thumb|250px|חוק קולון]] | ||
| + | |||
| + | [http://www.walla.co.il. אתר משעמם אחר] | ||
גרסה מתאריך 12:04, 2 בדצמבר 2009
מבטא את הנטיה של אטומים שונים למשוך אלקטרונים. הערכים של האלקטרושליליות הם בין 0 ל- 4. ערך האלקטרושליליות גבוה, מציין נטייה גדולה יותר למשוך אלקטרונים. ניתן למצוא את ערכי האלקטרושליליות של כל יסוד בטבלה מתאימה
שמציג ערכי אלקטרושליליות של יסודות
- כללי אצבע:
1.מתכות הן בעלות אלקטרושליליות נמוכה משל אל-מתכות.
2. לפלואור אלקטרושליליות הגבוהה ביותר. ככל שמתרחקים ממנו האלקטרושליליות יורדת.
3. למימן אלקטרושליליות הנמוכה מרב האל-מתכות.
4. אלקטרושליליות היא גודל שתלוי בין היתר באנרגיית ינון ,זיקה אלקטרונית ולכן מתנהגת כמוהם. לכן, ניתן לנבא למי תהיה אלקטרושליליות גבוהה יותר עפ"י המיקום בטבלה המחזורית (בדומה לאנרגיית יינון).
- יש לזכור ערכי אלקטרושליליות של אטומים נבחרים כמו: פלואור(F): 4 , חמצן (O) 3.5, כלור(Cl), וחנקן(N)-3, פחמן(C) -2.5, מימן (H) – 2.1 . כאמור,המימן בעל האלקטרושליליות הנמוכה ביותר מבין כל האל מתכות.