קוטביות מולקולה: הבדלים בין גרסאות
(←'''קוטביות מולקולה''') |
(←'''היבטים פדגוגיים''') |
||
| שורה 22: | שורה 22: | ||
=='''מתי המולקולה קוטבית?'''== | =='''מתי המולקולה קוטבית?'''== | ||
='''היבטים פדגוגיים'''= | ='''היבטים פדגוגיים'''= | ||
| + | הקובץ הבא כולל סיכום של הקשר בן מבנה המלוקולה וקוטביותה | ||
='''קישורים חיצוניים'''= | ='''קישורים חיצוניים'''= | ||
לערך קוטביות מולקולה באתר ויקיפידיה [http://en.wikipedia.org/wiki/Chemical_polarity לחץ כאן] | לערך קוטביות מולקולה באתר ויקיפידיה [http://en.wikipedia.org/wiki/Chemical_polarity לחץ כאן] | ||
גרסה מתאריך 17:07, 22 בדצמבר 2009
תוכן עניינים
קוטביות מולקולה
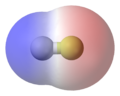
מולקולה קוטבית היא מולקולה שהענן האלקטרוני שלה אינו מחולק בצורה סמטרית. אי הסימטריה בהסתדרות האלקטרונים סביב המולקולה יוצרת דו קוטב קבוע. כלומר הענן האלקטרוני באיזור אחד של המולקולה צפוף יותר מהאיזור השני. איזור שבו הענן האלקטרוני צפוף יותר יש מיסוך טוב למטען החיובי של הגרעין לכן למעשה באיזור זה יש מטען חלקי שלילי, ובאיזור שהענן האלקטרוני דליל אין מיסוך טוב של המטען החיובי של הגרעין לכן האיזור הוא למעשה אזור של מטען חלקי חיובי
דוגמא המולקולה מימן כלורי HCl
האלקטרושליליות של המימן היא 2.1 ואילו של הכלור היא 3.0 . כלומר אטום מושך אליו אלקטרונים במידה רבה יותר מאשר אטום המימן. לכן במולקולת המימן כלורי הענן האלקטרוני אינו סימטרי, יש סיכוי רב יותר למצוא את זוג אלקטרוני המשותף בקרבת הכלור מאשר בקרבת המימן. אפשר להגיד שהענן האלקטרוני צפוף יותר ליד אטום הכלור והוא דליל יותר ליד אטום המימן. לכן אטום הכלור יהי בעל מטען חלקי שלילי ואילו אטם המימן בעל מטען חלקי חיובי
האם קשר קוולנטי קוטבי גורם בהכרח למולקולה להיות קוטבית?
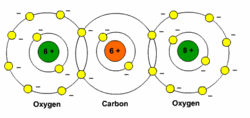
הקשרים הקוולנטיים הקוטביים במולקולה אינם גורמים בהכרח למולקולה להיות קוטבית למשל החומר פחמן דו חמצני O=C=O, הקשר (C=O)הוא קשר קוולנטי קוטבי אבל בסך הכל חלוקת המטען על פני המולקולה הוא סימטרי , המטען השלילי סביב שני החמצנים זהה
מתי המולקולה קוטבית?
היבטים פדגוגיים
הקובץ הבא כולל סיכום של הקשר בן מבנה המלוקולה וקוטביותה
קישורים חיצוניים
לערך קוטביות מולקולה באתר ויקיפידיה לחץ כאן