טבלה מחזורית: הבדלים בין גרסאות
(←טבלה מחזורית) |
מ (הטבלה המחזורית הועבר לטבלה מחזורית) |
||
| (16 גרסאות ביניים של 5 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
= טבלה מחזורית = | = טבלה מחזורית = | ||
| − | הטבלה המחזורית המכונה גם טבלת מנדלייב, היא שיטת מיון שהוצעה לראשונה על ידי הכימאי הרוסי דמיטרי מנדלייב ב-1869, ומציגה את כל היסודות לפי המספר האטומי והסמל הכימי של האטומים שלהם.[[Image:Perdioic table.jpg|thumb|left|250px|טבלה מחזורית]] | + | הטבלה המחזורית המכונה גם טבלת מנדלייב, היא שיטת מיון שהוצעה לראשונה על ידי הכימאי הרוסי דמיטרי מנדלייב ב-1869, ומציגה את כל היסודות לפי המספר האטומי והסמל הכימי של האטומים שלהם. |
| + | |||
| + | דמיטרי מנדלייב נולד בסיביר והיה הילד ה-17 במשפחה. הוא למד במכללת חינוך אותה סים בשנת 1855. בשנת 1867 מנדלייב התחיל לחבר ספר לימוד " בסיס של כימיה" ומייד נתקל בקושי לסדר את החומר על היסודות בצורה סיסטמטית. לאט לאט הוא הגיע למסקנה שבין תכונות היסודות הכימיים לבין מסה שלהם קיימת חוקיות מסויימת: יסודות אשר מסודרים לפי מסה אטומית עולה מראים מחזוריות בתכונות שלהם. | ||
| + | |||
| + | [[Image:Perdioic table.jpg|thumb|left|250px|טבלה מחזורית]] | ||
| | ||
| שורה 19: | שורה 23: | ||
<br> | <br> | ||
| − | + | <br> | |
| − | + | הטבלה המחזורית היא טבלת היסודות הכימיים, המסודרים על פי מספר אטומי עולה ועל פי קבוצות בעלות תכונות כימיות דומות. מתחילת המאה ה-19 נערכו ניסיונות לסדר את היסודות הידועים (אז היו 69 יסודות בלבד) לפי קבוצות בעלי תכונות דומות. בשנת 1869, סידרו את היסודות בשורות אופקיות זו מעל זו, לפי מסה אטומית עולה, כל שיסודות בעלי תכונות דומות יסתדרו בעמודות נפרדות. סידור זה הוא הטבלה המחזורית. | |
| − | + | בטבלה המחזורית המודרנית מסודרים כל היסודות שבטבע לפי מספר אטומי ולא לפי מסה אטומית. הטבלה מורכבת משורות וטורים. כל שורה מתחילה ביסוד עם אלקטרון אחד בקליפה החיצונית של האטום, ומסתיימת ביסוד עם 8 אלקטרונים בקליפה החיצונית, פרט לשורה הראשונה בטבלה. בכל טור נמצאים יסודות בעלי מבנה אלקטרוני דומה, כלומר מבנה דומה של אלקטרונים ברמה החיצונית של האטום, ולכן תכונותיהם הפיזיקליות והכימיות דומות. סידור היסודות לפי הערכות האלקטרונים יוצר הישנות מחזורית של מספר תכונות כתלות במספר האטומי. רדיוס אטומי : כידוע, רוב רובה של מסת האטום מרוכזת במרכזו, בגרעין שמטענו חיובי. סביב הגרעין פזורים האלקטרונים במרחב האטומי, כענן של מטען שלילי, במרחקים שונים מהגרעין, בגלל היותם בעלי אנרגיה שונה (כלומר ככל שהאלקטרון קרוב יותר לגרעין, כך האנרגיה שלו נמוכה יותר). מכיוון שלא ניתן לקבוע בוודאות את מיקומו של האלקטרון באטום, משתמשים במושג ענן מטען כדי לציין את מיקומם של האלקטרונים על ידי הסתברות. לשיא ההסתברות קוראים רדיו אטומי. בכל שורה בטבלה המחזורית, משמאל לימין הרדיוס האטומי הולך וקטן, כך שהאטום הגדול ביותר בכל שורה נמצא בטור הראשון, והאטום הקטן ביותר נמצא בטור השביעי. זה נובע מכך שככל שיש יותר אלקטרונים על הקליפה כך הם נמשכים יותר כלפי הגרעין ולכן הרדיוס האטומי הולך וקטן. להבדיל, לאורך הטור, הרדיוס האטומי רק הולך וגדל, וזאת עקב היתווספותן של עוד רמות של אלקטרונים. | |
| − | + | ==[[אנרגיית יינון]]== | |
| − | + | אנרגיית יינון היא האנרגיה הדרושה להרחקת אלקטרון מהקליפה החיצונית של האטום, כשהוא נמצא במצב גזי. ככל שהמשיכה החשמלית בין המטען החיובי של הגרעין לבין האלקטרון גדולה יותר, כך נדרשת יותר אנרגיה להרחקת האלקטרון, ולכן אנרגיית היינון תהיה גדולה יותר. מאחר וניתן להרחיק יותר מאלקטרון אחד מאטום, אנרגיית היינון הראשונה תהיה נמוכה מאנרגיית היינון השנייה וזו נמוכה מהשלישית וכן הלאה. ממדידות אנרגית היינון השונות של אטום מסוים ניתן לקבוע את המבנה האלקטרוני של אותו אטום, משום שניתן לראות עליה גדולה מאוד בערכי אנרגיית היינון כאשר מוציאים אלקטרון מקליפה קרובה יותר לגרעין ועליה מתונה יותר כאשר מוציאים אלקטרון מאותה קליפה. בתהליך היינון, אנו מוציאים אלקטרון מאטום ניטרלי, והאטום הופך לחלקיק טעון חיובית הנקרא יון. בכל שורה בטבלה המחזורית הערך הנמוך ביותר של אנרגיית יינון הוא של היסודות בטור הראשון, והערך הגבוה ביותר הוא של היסודות שבטור האחרון. זה נובע מכך שככל שהאטום בטור יותר ימני, כך יש בו יותר פרוטונים שמושכים את האלקטרונים, ולכן הרחקת אלקטרון מהם דורשת יותר אנרגיה. גורם נוסף המשפיע על אנרגית היינון הוא המרחק בין האלקטרון החיצוני והגרעין. ככל שהמרחק גדל, כך עוצמת המשיכה של האלקטרונים קטנה, ולכן גם אנרגיית היינון קטנה. לדוגמה, האלקטרון הנוסף באטום הליתיום נמצא בקליפה השנייה ונמשך על ידי שלושה פרוטונים, אך אנרגיית היינון נמוכה מזו של ההליום והמימן. | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | בתהליך היינון, אנו מוציאים אלקטרון מאטום ניטרלי, והאטום הופך לחלקיק טעון חיובית הנקרא יון. בכל שורה בטבלה המחזורית הערך הנמוך ביותר של אנרגיית יינון הוא של היסודות בטור הראשון, והערך הגבוה ביותר הוא של היסודות שבטור האחרון. זה נובע מכך שככל שהאטום בטור יותר ימני, כך יש בו יותר פרוטונים שמושכים את האלקטרונים, ולכן הרחקת אלקטרון מהם דורשת יותר אנרגיה. | + | |
| − | גורם נוסף המשפיע על אנרגית היינון הוא המרחק בין האלקטרון החיצוני והגרעין. ככל שהמרחק גדל, כך עוצמת המשיכה של האלקטרונים קטנה, ולכן גם אנרגיית היינון קטנה. לדוגמה, האלקטרון הנוסף באטום הליתיום נמצא בקליפה השנייה ונמשך על ידי שלושה פרוטונים, אך אנרגיית היינון נמוכה מזו של ההליום והמימן. | + | |
| − | |||
| − | |||
| − | |||
| + | [[תמונה:firstionizationeng.GIF|center|thumb|600px|אנרגיות יינון ראשונות]] | ||
| − | |||
| − | |||
| − | |||
| − | הלוגנים | + | ---- |
| + | |||
| + | ==זיקה אלקטרונית== | ||
| + | זיקה אלקטרונית מוגדרת ככמות האנרגיה שיש להשקיע כדי להרחיק אלקטרון מיון שלילי (יון שבו מספר האלקטרונים גדול ממספר הפרוטונים) במצב גזי. אנרגיה זו מהווה מדד לזיקה של האטום לאלקטרון נוסף זה. ערכי הזיקה האלקטרונית הינם גבוהים ביותר עבור יסודות הטור השביעי, מכיוון שקבלת אלקטרון נוסף משמעו הערכות אלקטרונים כמו של גז אציל, שלהם יש שמונה אלקטרונים בקליפה החיצונית, דבר המכתיב את אדישותם ליצירת קשרים כימיים עם יסודות אחרים. ערכי הזיקה האלקטרונית השלילית ביותר הם של יסודות הטור השני והטור השמיני. ערכים חיוביים משמעם יון שלילי יציב, ואילו ערכים שליליים משמעם יון שלילי לא יציב. | ||
| + | |||
| + | ==משפחות כימיות== | ||
| + | ===מתכות אלקליות=== | ||
| + | לכל היסודות בקבוצה זו אלקטרון אחד בקליפה החיצונית ביותר, ולכן הם בעלי אנרגיית יינון נמוכה ורדיוס אטומי גדול, בהשוואה לאלו של היסודות האחרים. יסודות אלו הם מתכות אופייניות, רכות (פרט לליתיום) הפעילות מאוד מבחינה כימית, ומגיבות בעוצמה עם מים או חמצן, ולכן מתכות אלה מאוכסנות בשמן או נפט. אנרגיית היינון הנמוכה שלהן מסבירה את הפעילות הכימית הגבוהה שלהן. יסודות קבוצה זו יוצרים יונים חיוביים בעלי מטען 1+. | ||
| + | |||
| + | ===מתכות אלקליות עפרתיות=== | ||
| + | לכל היסודות בקבוצה זו שני אלקטרונים בקליפה החיצונית ביותר, דבר המסביר מדוע גם קבוצת יסודות זו פעילה מבחינה כימית. פעילות כימית זו נובעת מהנכונות של האטומים לאבד אלקטרונים בקלות, משתקפת באנרגית יינון נמוכה ובזיקה אלקטרונית נמוכה ביותר. אנרגיית היינון של מתכות קבוצה זו היא גבוהה מזו של המתכות האלקליות ולכן יסודות אלה הם פחות פעילים כימית. יסודות קבוצה זו יוצרים יונים בעלי מטען 2+, ומגיבים עם חמצן ליצירת תחמוצות. | ||
| + | |||
| + | ===הלוגנים=== | ||
| + | לכל היסודות הללו שבעה אלקטרונים בקליפה החיצונית. יסודות אלה הם אל מתכות מובהקות. הם יוצרים יונים העלי מטען 1-. יסודות אלה מתאפיינים ברדיוס אטומי קטן וערכי זיקה אלקטרונית גבוהים ביותר בהשוואה לאלו של היסודות האחרים. | ||
| + | |||
| + | ===גזים אצילים=== | ||
| + | ליסודות אלה יש שמונה אלקטרונים בקליפה החיצונית, דבר שמתאפיין באדישות הגזים ליצירת קשרים כימים עם יסודות אחרים. כל הגזים בקבוצה זו הינם חסרי ריח, צבע וטעם. ליסודות אלה יש אנרגיית יינון גבוהה ביותר וערכי זיקה אלקטרונית נמוכים ביותר, בהשוואה ליסודות האחרים | ||
| + | |||
| + | |||
| + | |||
| + | == '''תכנים פדגוגיים''' == | ||
| + | |||
| + | על מנת להמחיש את הדמיון בתכונות של משפחות כימיות בטבלה המחזורית, ניתן להראות [http://video.google.com/videoplay?docid=-2134266654801392897# סרטון, שמראה את תגובת המתכות האלקליות עם מים] | ||
| + | |||
| + | (מתוך תוכנית brainiacs) | ||
| + | |||
| + | == '''קישורים חיצוניים''' == | ||
| + | |||
| + | * טבלה מחזורית אינטראקטיבית מורחבת -[http://www.ptable.com/ Ptable] | ||
| + | |||
| + | * טבלה מחזורית בעברית עם פירוט יסודות בעברית - [http://www.ort.org.il/elements/ רשת אורט] | ||
| − | + | * המגמות השונות מוצגות באופן גרפי בטבלה המחזורית, מספר אטומי, מסה אטומית, רדיוס אטומי, אלקטרושליליות ועוד [http://www.hasdeu.bz.edu.ro/softuri/fizica/mariana/Atomica/Table/lessons/04periodic/periodic.swf Trends of the Periodic Table] | |
| + | * [http://www.khayma.com/muhannad/FlashTutorials/Periodic.swf הסברים גרפיים וטקסטואלים על הטבלה המחזורית] ההסבר מתחיל בהצגה של מועדי גילוי היסודות השונים לפי תקופות החל מהעת העתיקה. רדיו אטומי (כולל דף שאלות ותשובות (אנגלית)), רדיוס יוני ועוד. | ||
[[Category:טבלה_מחזורית]] | [[Category:טבלה_מחזורית]] | ||
גרסה אחרונה מתאריך 21:57, 15 באוגוסט 2013
תוכן עניינים
טבלה מחזורית
הטבלה המחזורית המכונה גם טבלת מנדלייב, היא שיטת מיון שהוצעה לראשונה על ידי הכימאי הרוסי דמיטרי מנדלייב ב-1869, ומציגה את כל היסודות לפי המספר האטומי והסמל הכימי של האטומים שלהם.
דמיטרי מנדלייב נולד בסיביר והיה הילד ה-17 במשפחה. הוא למד במכללת חינוך אותה סים בשנת 1855. בשנת 1867 מנדלייב התחיל לחבר ספר לימוד " בסיס של כימיה" ומייד נתקל בקושי לסדר את החומר על היסודות בצורה סיסטמטית. לאט לאט הוא הגיע למסקנה שבין תכונות היסודות הכימיים לבין מסה שלהם קיימת חוקיות מסויימת: יסודות אשר מסודרים לפי מסה אטומית עולה מראים מחזוריות בתכונות שלהם.
הטבלה המחזורית היא טבלת היסודות הכימיים, המסודרים על פי מספר אטומי עולה ועל פי קבוצות בעלות תכונות כימיות דומות. מתחילת המאה ה-19 נערכו ניסיונות לסדר את היסודות הידועים (אז היו 69 יסודות בלבד) לפי קבוצות בעלי תכונות דומות. בשנת 1869, סידרו את היסודות בשורות אופקיות זו מעל זו, לפי מסה אטומית עולה, כל שיסודות בעלי תכונות דומות יסתדרו בעמודות נפרדות. סידור זה הוא הטבלה המחזורית.
בטבלה המחזורית המודרנית מסודרים כל היסודות שבטבע לפי מספר אטומי ולא לפי מסה אטומית. הטבלה מורכבת משורות וטורים. כל שורה מתחילה ביסוד עם אלקטרון אחד בקליפה החיצונית של האטום, ומסתיימת ביסוד עם 8 אלקטרונים בקליפה החיצונית, פרט לשורה הראשונה בטבלה. בכל טור נמצאים יסודות בעלי מבנה אלקטרוני דומה, כלומר מבנה דומה של אלקטרונים ברמה החיצונית של האטום, ולכן תכונותיהם הפיזיקליות והכימיות דומות. סידור היסודות לפי הערכות האלקטרונים יוצר הישנות מחזורית של מספר תכונות כתלות במספר האטומי. רדיוס אטומי : כידוע, רוב רובה של מסת האטום מרוכזת במרכזו, בגרעין שמטענו חיובי. סביב הגרעין פזורים האלקטרונים במרחב האטומי, כענן של מטען שלילי, במרחקים שונים מהגרעין, בגלל היותם בעלי אנרגיה שונה (כלומר ככל שהאלקטרון קרוב יותר לגרעין, כך האנרגיה שלו נמוכה יותר). מכיוון שלא ניתן לקבוע בוודאות את מיקומו של האלקטרון באטום, משתמשים במושג ענן מטען כדי לציין את מיקומם של האלקטרונים על ידי הסתברות. לשיא ההסתברות קוראים רדיו אטומי. בכל שורה בטבלה המחזורית, משמאל לימין הרדיוס האטומי הולך וקטן, כך שהאטום הגדול ביותר בכל שורה נמצא בטור הראשון, והאטום הקטן ביותר נמצא בטור השביעי. זה נובע מכך שככל שיש יותר אלקטרונים על הקליפה כך הם נמשכים יותר כלפי הגרעין ולכן הרדיוס האטומי הולך וקטן. להבדיל, לאורך הטור, הרדיוס האטומי רק הולך וגדל, וזאת עקב היתווספותן של עוד רמות של אלקטרונים.
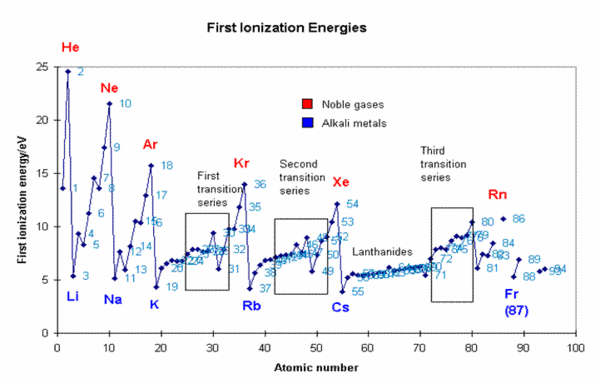
אנרגיית יינון
אנרגיית יינון היא האנרגיה הדרושה להרחקת אלקטרון מהקליפה החיצונית של האטום, כשהוא נמצא במצב גזי. ככל שהמשיכה החשמלית בין המטען החיובי של הגרעין לבין האלקטרון גדולה יותר, כך נדרשת יותר אנרגיה להרחקת האלקטרון, ולכן אנרגיית היינון תהיה גדולה יותר. מאחר וניתן להרחיק יותר מאלקטרון אחד מאטום, אנרגיית היינון הראשונה תהיה נמוכה מאנרגיית היינון השנייה וזו נמוכה מהשלישית וכן הלאה. ממדידות אנרגית היינון השונות של אטום מסוים ניתן לקבוע את המבנה האלקטרוני של אותו אטום, משום שניתן לראות עליה גדולה מאוד בערכי אנרגיית היינון כאשר מוציאים אלקטרון מקליפה קרובה יותר לגרעין ועליה מתונה יותר כאשר מוציאים אלקטרון מאותה קליפה. בתהליך היינון, אנו מוציאים אלקטרון מאטום ניטרלי, והאטום הופך לחלקיק טעון חיובית הנקרא יון. בכל שורה בטבלה המחזורית הערך הנמוך ביותר של אנרגיית יינון הוא של היסודות בטור הראשון, והערך הגבוה ביותר הוא של היסודות שבטור האחרון. זה נובע מכך שככל שהאטום בטור יותר ימני, כך יש בו יותר פרוטונים שמושכים את האלקטרונים, ולכן הרחקת אלקטרון מהם דורשת יותר אנרגיה. גורם נוסף המשפיע על אנרגית היינון הוא המרחק בין האלקטרון החיצוני והגרעין. ככל שהמרחק גדל, כך עוצמת המשיכה של האלקטרונים קטנה, ולכן גם אנרגיית היינון קטנה. לדוגמה, האלקטרון הנוסף באטום הליתיום נמצא בקליפה השנייה ונמשך על ידי שלושה פרוטונים, אך אנרגיית היינון נמוכה מזו של ההליום והמימן.
זיקה אלקטרונית
זיקה אלקטרונית מוגדרת ככמות האנרגיה שיש להשקיע כדי להרחיק אלקטרון מיון שלילי (יון שבו מספר האלקטרונים גדול ממספר הפרוטונים) במצב גזי. אנרגיה זו מהווה מדד לזיקה של האטום לאלקטרון נוסף זה. ערכי הזיקה האלקטרונית הינם גבוהים ביותר עבור יסודות הטור השביעי, מכיוון שקבלת אלקטרון נוסף משמעו הערכות אלקטרונים כמו של גז אציל, שלהם יש שמונה אלקטרונים בקליפה החיצונית, דבר המכתיב את אדישותם ליצירת קשרים כימיים עם יסודות אחרים. ערכי הזיקה האלקטרונית השלילית ביותר הם של יסודות הטור השני והטור השמיני. ערכים חיוביים משמעם יון שלילי יציב, ואילו ערכים שליליים משמעם יון שלילי לא יציב.
משפחות כימיות
מתכות אלקליות
לכל היסודות בקבוצה זו אלקטרון אחד בקליפה החיצונית ביותר, ולכן הם בעלי אנרגיית יינון נמוכה ורדיוס אטומי גדול, בהשוואה לאלו של היסודות האחרים. יסודות אלו הם מתכות אופייניות, רכות (פרט לליתיום) הפעילות מאוד מבחינה כימית, ומגיבות בעוצמה עם מים או חמצן, ולכן מתכות אלה מאוכסנות בשמן או נפט. אנרגיית היינון הנמוכה שלהן מסבירה את הפעילות הכימית הגבוהה שלהן. יסודות קבוצה זו יוצרים יונים חיוביים בעלי מטען 1+.
מתכות אלקליות עפרתיות
לכל היסודות בקבוצה זו שני אלקטרונים בקליפה החיצונית ביותר, דבר המסביר מדוע גם קבוצת יסודות זו פעילה מבחינה כימית. פעילות כימית זו נובעת מהנכונות של האטומים לאבד אלקטרונים בקלות, משתקפת באנרגית יינון נמוכה ובזיקה אלקטרונית נמוכה ביותר. אנרגיית היינון של מתכות קבוצה זו היא גבוהה מזו של המתכות האלקליות ולכן יסודות אלה הם פחות פעילים כימית. יסודות קבוצה זו יוצרים יונים בעלי מטען 2+, ומגיבים עם חמצן ליצירת תחמוצות.
הלוגנים
לכל היסודות הללו שבעה אלקטרונים בקליפה החיצונית. יסודות אלה הם אל מתכות מובהקות. הם יוצרים יונים העלי מטען 1-. יסודות אלה מתאפיינים ברדיוס אטומי קטן וערכי זיקה אלקטרונית גבוהים ביותר בהשוואה לאלו של היסודות האחרים.
גזים אצילים
ליסודות אלה יש שמונה אלקטרונים בקליפה החיצונית, דבר שמתאפיין באדישות הגזים ליצירת קשרים כימים עם יסודות אחרים. כל הגזים בקבוצה זו הינם חסרי ריח, צבע וטעם. ליסודות אלה יש אנרגיית יינון גבוהה ביותר וערכי זיקה אלקטרונית נמוכים ביותר, בהשוואה ליסודות האחרים
תכנים פדגוגיים
על מנת להמחיש את הדמיון בתכונות של משפחות כימיות בטבלה המחזורית, ניתן להראות סרטון, שמראה את תגובת המתכות האלקליות עם מים
(מתוך תוכנית brainiacs)
קישורים חיצוניים
- טבלה מחזורית אינטראקטיבית מורחבת -Ptable
- טבלה מחזורית בעברית עם פירוט יסודות בעברית - רשת אורט
- המגמות השונות מוצגות באופן גרפי בטבלה המחזורית, מספר אטומי, מסה אטומית, רדיוס אטומי, אלקטרושליליות ועוד Trends of the Periodic Table
- הסברים גרפיים וטקסטואלים על הטבלה המחזורית ההסבר מתחיל בהצגה של מועדי גילוי היסודות השונים לפי תקופות החל מהעת העתיקה. רדיו אטומי (כולל דף שאלות ותשובות (אנגלית)), רדיוס יוני ועוד.