אדריכלות מולקולות: הבדלים בין גרסאות
(←דוגמאות) |
|||
| (7 גרסאות ביניים של משתמש אחד אינן מוצגות) | |||
| שורה 19: | שורה 19: | ||
: | : | ||
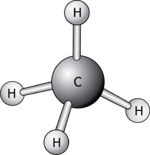
| − | 1. במולקולה | + | 1. לפי נוסחת ייצוג לואיס במולקולה CH<sub>4</sub> לאטום המרכזי מחוברים ארבעה זוגות אלקטרונים קושרים ואף זוג אלקטרונים לא-קושר אחד.לפי מודל VSEPR מדובר במולקולה טטראדרית. |
| + | [[Image:B-38.jpg|thumb|center|150px|מולקולה בעלת צורה טטראדרית]] | ||
| + | 2. לפי נוסחת ייצוג לואיס במולקולה NF<sub>3</sub> לאטום המרכזי מחוברים שלושה זוגות אלקטרונים קושרים וזוג אלקטרונים לא-קושר אחד – בסך-הכל ארבעה אזורים של צפיפות אלקטרונים גבוהה. לפי מודל VSEPR , סידור האלקטרוני הוא טטראהדרי, המרחק בין שלושת הזוגות הקושרים וזוג אלקטרונים לא-קושר הוא המרבי כאשר אטומים הקשורים ל-N יוצרים פירמידה משולשת. | ||
| − | + | [[Image:B-39.jpg|thumb|center|150px|מולקולה בעלת צורה של פירמידה משולשת]] | |
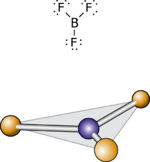
| − | + | <br>3.לפי נוסחת ייצוג לואיס במולקולה BF<sub>3</sub> לאטום המרכזי מחוברים שלושה זוגות אלקטרונים קושרים ואף זוג אלקטרונים לא-קושר אחד. לפי מודל VSEPR , המרחק בין שלושת הזוגות הקושרים הוא המרבי כאשר הם נמצאים בפינותיו של משולש שווה צלעות. סידור האלקטרוני הוא מישורי משולש, מכיוון שלכל זוג קושר מחובר אטום F, מולקולת ה- BF<sub>3</sub> היא היא מישורית משולשת וכל שלוש הזוויות FBF הוא בנות 120<sup>0</sup>. | |
| + | [[Image:B-37.jpg|thumb|center|150px|מולקולה בעלת צורה של משולש מישורי]] | ||
| + | 4.לפי נוסחת ייצוג לואיס במולקולה H<sub>2</sub>O לאטום המרכזי מחוברים שני זוגות אלקטרונים קושרים ושני זוגות אלקטרונים לא קושרים. לפי מודל VSEPR ,מדובר במולקולה זויתית. | ||
| − | + | [[Image:B-46a.jpg|thumb|center|150px|מולקולה בעלת צורה זויתית]] | |
| − | + | <br> | |
| + | |||
| + | <br> | ||
| + | |||
| + | <br> | ||
<br> | <br> | ||
== כלל שני == | == כלל שני == | ||
| + | |||
| + | |||
| + | |||
: | : | ||
| שורה 44: | שורה 55: | ||
== דוגמא == | == דוגמא == | ||
| − | |||
| − | |||
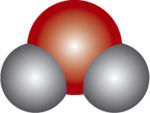
למולקולת CO<sub>2</sub> יש מבנה קווי דומה לזה של BeCl<sub>2 </sub>, להוציא נוכחותם של קשרים כפולים. | למולקולת CO<sub>2</sub> יש מבנה קווי דומה לזה של BeCl<sub>2 </sub>, להוציא נוכחותם של קשרים כפולים. | ||
| שורה 51: | שורה 60: | ||
<br> | <br> | ||
| − | [[תמונה:b-46_5.jpg| | + | [[תמונה:b-46_5.jpg|center|150px|מולקולה בעלת צורה קוית]] |
| + | |||
| + | |||
| + | |||
| + | : | ||
| + | |||
== כלל שלישי == | == כלל שלישי == | ||
| שורה 64: | שורה 78: | ||
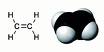
:במולקולת אתן CH<sub>2</sub>=CH<sub>2</sub> יש שני מרכזים שעלינו להביא בחשבון: שני אטומי הפחמן. לפי נוסחת מבנה לואיס, לכל אטום פחמן יש שלושה אזורים של<sub></sub> ריכוז אלקטרונים: שני קשרים יחידים וקשר כפול אחד. במולקולה זו אין זוגות אלקטרונים לא-קושרים. הסידור סביב כל אטום פחמן הוא לפיכך מישורי משולש, שתי זוויות HCH יהיו 120<sup>0</sup>. ניסויים הראו כי אלה הם אכן גודליהן. | :במולקולת אתן CH<sub>2</sub>=CH<sub>2</sub> יש שני מרכזים שעלינו להביא בחשבון: שני אטומי הפחמן. לפי נוסחת מבנה לואיס, לכל אטום פחמן יש שלושה אזורים של<sub></sub> ריכוז אלקטרונים: שני קשרים יחידים וקשר כפול אחד. במולקולה זו אין זוגות אלקטרונים לא-קושרים. הסידור סביב כל אטום פחמן הוא לפיכך מישורי משולש, שתי זוויות HCH יהיו 120<sup>0</sup>. ניסויים הראו כי אלה הם אכן גודליהן. | ||
| + | |||
| + | |||
| + | [[תמונה:eten.jpg|center|thumb|350px|צורה גיאומטרית של אתן]] | ||
גרסה אחרונה מתאריך 21:54, 15 באוגוסט 2013
תוכן עניינים
אדריכלות מולקולות
מבוא:
תיאוריית הקשר של לואיס אנו מציגים מבנה של המולקולות כייצוגים דו-ממדיים של הקשרים בין אטומים – של הערכיות שלהם. מלבד הצורונים הפשוטים ביותר, מבני לואיס לא נועדו לתאר את סידור האטומים במרחב. מודל הדחייה זוגות האלקטרונים ברמות הערכיות : Valence-Shell Electron-Pair Repulsion model (בקיצור VSEPR) מרחיב את תיאוריית הקשר של לואיס ומוסיף לה כללים המסבירים את זוויות הקשר האלה, על מנת להסביר את צורות המולקולות. הראשונים שפיתחו את מודל VSEP היו הכימאים הבריטים: . N. Sidgwick , H. Powel כימאי הקנדי R. Gillespie המשיך ולשכללו.
מהי מודל VSEPR ? ניתן לבטא את המודל בעזרת 3 כללים עיקריים:
כלל ראשון
אזורים בעלי ריכוז אלקטרונים גבוה דוחים זה לה זה, ולכן הם נוטים להתרחק זה מזה ככל האפשר תוך שמירה על אותו המרחק מהאטום המרכזי, מכיוון שבמצב זה הדחייה ביניהם היא הנמוכה ביותר. לאחר שמצאנו את הסידור שבו אזורים אלה מרוחקים זה מזה ככל האפשר, הנקרא סידור האלקטרונים במולקולה, אנו בודקים היכן נמצאים האטומים ומזהים את צורת המולקולה.
דוגמאות
1. לפי נוסחת ייצוג לואיס במולקולה CH4 לאטום המרכזי מחוברים ארבעה זוגות אלקטרונים קושרים ואף זוג אלקטרונים לא-קושר אחד.לפי מודל VSEPR מדובר במולקולה טטראדרית.
2. לפי נוסחת ייצוג לואיס במולקולה NF3 לאטום המרכזי מחוברים שלושה זוגות אלקטרונים קושרים וזוג אלקטרונים לא-קושר אחד – בסך-הכל ארבעה אזורים של צפיפות אלקטרונים גבוהה. לפי מודל VSEPR , סידור האלקטרוני הוא טטראהדרי, המרחק בין שלושת הזוגות הקושרים וזוג אלקטרונים לא-קושר הוא המרבי כאשר אטומים הקשורים ל-N יוצרים פירמידה משולשת.
3.לפי נוסחת ייצוג לואיס במולקולה BF3 לאטום המרכזי מחוברים שלושה זוגות אלקטרונים קושרים ואף זוג אלקטרונים לא-קושר אחד. לפי מודל VSEPR , המרחק בין שלושת הזוגות הקושרים הוא המרבי כאשר הם נמצאים בפינותיו של משולש שווה צלעות. סידור האלקטרוני הוא מישורי משולש, מכיוון שלכל זוג קושר מחובר אטום F, מולקולת ה- BF3 היא היא מישורית משולשת וכל שלוש הזוויות FBF הוא בנות 1200.
4.לפי נוסחת ייצוג לואיס במולקולה H2O לאטום המרכזי מחוברים שני זוגות אלקטרונים קושרים ושני זוגות אלקטרונים לא קושרים. לפי מודל VSEPR ,מדובר במולקולה זויתית.
כלל שני
איננו מבחינים בין קשרים יחידים למרובים. קשר מרובה נחשב לאזור יחיד של ריכוז אלקטרונים גבוה.
דוגמא
למולקולת CO2 יש מבנה קווי דומה לזה של BeCl2 , להוציא נוכחותם של קשרים כפולים.
כלל שלישי
כאשר יש יותר מאטום מרכזי אחד, אנו משרטטים את הקשרים סביב כל אטום בנפרד.
דוגמא
- במולקולת אתן CH2=CH2 יש שני מרכזים שעלינו להביא בחשבון: שני אטומי הפחמן. לפי נוסחת מבנה לואיס, לכל אטום פחמן יש שלושה אזורים של ריכוז אלקטרונים: שני קשרים יחידים וקשר כפול אחד. במולקולה זו אין זוגות אלקטרונים לא-קושרים. הסידור סביב כל אטום פחמן הוא לפיכך מישורי משולש, שתי זוויות HCH יהיו 1200. ניסויים הראו כי אלה הם אכן גודליהן.