מסיסות: הבדלים בין גרסאות
(←מסיסות של סוכרים) |
(←היבטים פדגוגיים) |
||
| שורה 59: | שורה 59: | ||
הפעילות מכילה מספר שאלות בהן משתמשים במיומנות השוואה. | הפעילות מכילה מספר שאלות בהן משתמשים במיומנות השוואה. | ||
| − | <br>[[Media:Rabota_sol.doc|פעילות בנושא "מסיסות"]] דף עבודה העוסק בתגובות ההמסה בממסים שונים | + | <br>[[Media:Rabota_sol.doc|פעילות בנושא "מסיסות"]] |
| + | |||
| + | דף עבודה העוסק בתגובות ההמסה בממסים שונים | ||
| + | |||
| + | |||
| + | [[מדיה:Tiun_yarden_talmid.doc|פעילות טיעון בנושא עישון נרגילה - דף עבודה לתלמיד]] | ||
<br>[[Media:Lab_sol.doc|ניסוי "ממסים ומומסים"]] | <br>[[Media:Lab_sol.doc|ניסוי "ממסים ומומסים"]] | ||
| שורה 71: | שורה 76: | ||
[[Media:Nerot.doc|ניסוי "הכנת נרות חנוכה"]] | [[Media:Nerot.doc|ניסוי "הכנת נרות חנוכה"]] | ||
| − | ניסוי חוויתי.מיועד לחיזוק והעמקת הידע בנושאים "חומרים מולקולריים" ו"מסיסות החומרים" | + | ניסוי חוויתי.מיועד לחיזוק והעמקת הידע בנושאים "חומרים מולקולריים" ו"מסיסות החומרים" |
== קישורים חיצוניים == | == קישורים חיצוניים == | ||
גרסה מתאריך 06:25, 13 ביוני 2010
תוכן עניינים
מסיסות
הגדרה
מסיסות של חומר מוגדרת כיכולתו של חומר להשתלב במולקולות חומר אחר. בדרך כלל ישנם שני מרכיבים עיקריים: ממס, בעל הנפח הגדול יותר ובדרך כלל נוזלי ומומס, בעל הכמות הקטנה יותר והיכול להיות בשלושת מצבי הצבירה. קיימת סברה שסגסוגות (מסגים) הינם תמיסות של מתכות בהרכב לא קבוע, ובמקרה שכזה, התמיסה היא של מוצקים.
מסיסות חומרים יוניים
חומרים יוניים נמסים בחומר אחר בשל יכולת הגביש היוני להתפרק לחלקיקיו ולהשתלב בינות מולקולות הממס. אופן ההמסה הוא, שהממס מושך מעל שטח פני הגביש היוני (המומס) את היונים. כדי שפעולת המסה זו תצא לפועל דרוש ממש המתאים בתכונותיו למומס, קרי, ממס מקוטב, שכן היונים עצמם מקוטבים ובעלי מטען. חומר יוני המתמוסס בממס שלו נקרא חומר יוני קל- תמס (כלומר: קל להמסה, בעל מסיסות גבוהה). חומר יוני שאיננו מתמוסס בקלות ואחוז היונים הנמשכים ממנו הוא נמוך עד מזערי, נקרא חומר יוני קשה-תמס (כלומר: קשה להמסה, מסיסותו נמוכה עד זניחה).
מסיסות חומרים מולקולריים
חומרים מולקולריים נמסים בממסים ללא פירוק החומר לחלקיקיו כמו במקרה של סריגים יוניים. המולקולה יוצרת קשרים בינמולקולריים חזקים עם הממס (אם הממס הינו מים- אזי קשרי מימן ואם הממס הינו אל-מימי אזי- קשרי ון-דר-ולס). כל המולקולה כולה, מוקפת במולקולות הממס ומשתלבת בו.
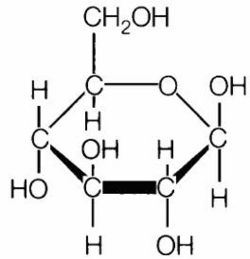
מסיסות של סוכרים
חד סוכרים הם רב כהלים המכילים גם קבוצה קרבונילית (אלדהיד או קטון). דו סוכרים הם פחממות שהמולקולות שלהן מורכבות משתי טבעות חד סוכר. רב סוכרים הם פחמימות הבנויות מיותר מ 10 שיירי חד סוכר.
.חד סוכרים ודו סוכרים מתמוססים במים כיוון שהם מכילים קבוצות כהליות רבות בהן יכולים להשתלב עם קשרי המימן של המים.
רב סוכרים אינם מתמוססים במים בגלל שנוצרות אינטרקציות רבות של קשרי מימן בתוך השרשרות ובין השרשרות ולא מתאפשרת יצירת קשרי מימן עם מולקולות המים במידה מספקת.
חיזוי מסיסות
הקו המפריד בין מה שאנו מכנים מסיס לבין מה שאנו מכנים בלתי מסיס הוא שרירותי, אבל להלן קריטריונים משותפים המתארים חומרים כבעלי מסיסות גבוהה, בעלי מסיסות זניחה, או בעלי מסיסות נמוכה.
אם פחות מ-1 גרם של חומר יתמוסס ב-100 מ"ל (או 100 גרם) ממס, החומר נחשב בלתי מסיס. אם יותר מ-10 גרם של חומר יתמוסס ב-100 מ"ל (או 100 גרם) ממס, החומר נחשב מסיס.
אם בין 1 ל-10 גרם של חומר יתמוסס ב-100 מ"ל (או 100 גרם) ממס, החומר נחשב מסיס חלקית.
מומסים שהשתלבותם בין מולקולות הממס היא טובה, מעידים על עובדת יצירת קשרים בינמולקולריים דומים של הממס. עובדה זו גורמת להם להתערבב היטב בתמיסה. לדוגמא: מולקולות של חומר היוצר קשרי מימן ישתלבו היטב בין מולקולות המים היוצרים קשרי מימן אף הם. מומס בעל חלקיקים טעונים (כמו חומר יוני) מסוגלים להימשך למולקולות ממס קוטביות (כמו מים). מומס המורכב ממולקולות היוצרות קשרי ון-דר-ולס, יכול להשתלב היטב במולקולות ממס היוצר אף הוא קשרי ון-דר-ולס. לדוגמא: פחמימנים, עשויים להתמוסס היטב בממסים אל-מימיים ולא להתמוסס בממסים מימיים.
תמיסה בשיווי משקל כימי שאינה יכולה להכיל עוד מומס, נקראת תמיסה רוויה (saturated).
מלחים קלי-תמס (בעלי מסיסות גבוהה) הם מלחים המתפרקים כליל למרכיביהם היוניים בתמיסה מימית. זאת לעומת מלחים קשה-תמס (בעלי מסיסות נמוכה עד זניחה) שהם מקיימים שיווי משקל בין יונים בתמיסה לבין המוצק היוני.
קבוע מכפלת המסיסות (Ksp = solubility-product constant) - הוא הערך המרבי האפשרי של מכפלת ריכוזי יונים של חומר יוני כלשהו שעשוי להיות בתמיסה. כל תוספת עודפת של אחד היונים, יגרום לכך שמכפלת ריכוזם יהיה גבוהה ממכפלת קבוע המסיסות דבר אשר יגרום לכך שישקע המלח כמוצק בתמיסה.
בספרות יש טבלאות עם ערכי מכפלת מסיסות לתרכובות שונות.
היבטים פדגוגיים
הפעילות מכילה מספר שאלות בהן משתמשים במיומנות השוואה.
דף עבודה העוסק בתגובות ההמסה בממסים שונים
פעילות טיעון בנושא עישון נרגילה - דף עבודה לתלמיד
הניסוי עוסק בהמסה יונית לעומת ההמסה המולקולרית.
ניסוי "הכנת קרם ידיים" הוא הניסוי ברמה 1.מטרות הניסוי הן להעמיק ולחזק את ידיעות התלמיד בפרק "מבנה וקישור" ובעיקר בעניין החומרים המולקולריים,מבנה ותכונותיהם.הניסוי ניתן לביצוע גם בתנאי בית-הספר וגם במסגרת הפעילות "כימיה בחיי יום-יום" במכון דוידסון למדע.
ניסוי חוויתי.מיועד לחיזוק והעמקת הידע בנושאים "חומרים מולקולריים" ו"מסיסות החומרים"