אורביטל: הבדלים בין גרסאות
| שורה 34: | שורה 34: | ||
<br>ישנם מספר סוגי אורביטלים להם צורות מרחביות שונות: s,p,d,f | <br>ישנם מספר סוגי אורביטלים להם צורות מרחביות שונות: s,p,d,f | ||
| − | כדי לראות אורביטלים באטומים שונים כנס לקישור הבא: | + | כדי לראות אורביטלים באטומים שונים כנס לקישור הבא: [http://jchemed.chem.wisc.edu/JCEDLib/LivTexts/pChem/JCE2005p1880_2LTXT/QuantumStates/Bookfolder/L25OrbitalShapes.htm] |
| + | |||
בכל אורביטל יכולים להימצא שני אלקטרונים בעלי כיוני תנועה סיבובית (ספין) מנוגדים | בכל אורביטל יכולים להימצא שני אלקטרונים בעלי כיוני תנועה סיבובית (ספין) מנוגדים | ||
| − | באטומים עם מספר גדול של | + | באטומים עם מספר גדול של אלקטרונים הם מאכלסים קודם את האורביטל בעלת אנרגיה נמוכה ברמה גבוהה יותר ורק אחר כך אורביטלים ברמה גבוהה יותר. באיור ניתן לראות שלאורביטלים 3d אנרגיה גבוהה יותר מאורביטלים 4s ן-4p|. |
[[Image:Ramot energy.gif|תמונה:Ramot energy.gif]] | [[Image:Ramot energy.gif|תמונה:Ramot energy.gif]] | ||
| | ||
גרסה מתאריך 18:16, 5 בינואר 2010
אורביטל- המרחב סביב גרעין שבו יש סיכוי גדול למצוא את האלקטרון במרחב האטום. לפי מכניקה קוונטית האורביטל מאפיין גם את האנרגיה שיש לאלקטרון במצב יציב(לא מעורר) וגם צורתו של ענן האלקטרוני במרחב.
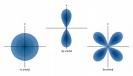
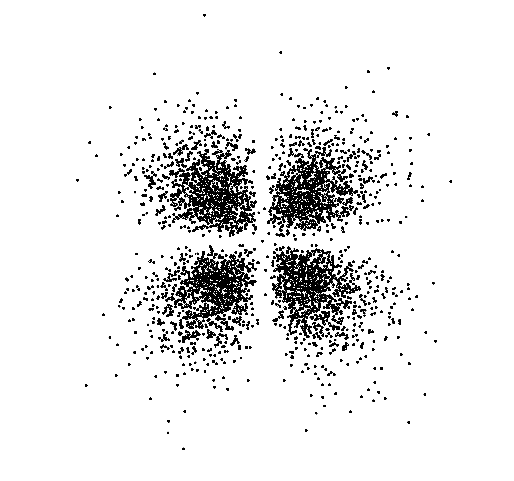
באיור ניתן לראות את צורה המרחבית של אורביטלים מסוג s (ספרי) ומסוג p (שמיניה תלת-מימדית)
הצגה כזאת של אורביטלים מקובלת בהרבה ספרי לימוד, אך היא יכולה להיות מקור לתפיסה שגויאה שאלקטרון נע במסלול מוגדר.
אורביטל הוא מכלול של כל התנועות המורכבות של אלקטרון.
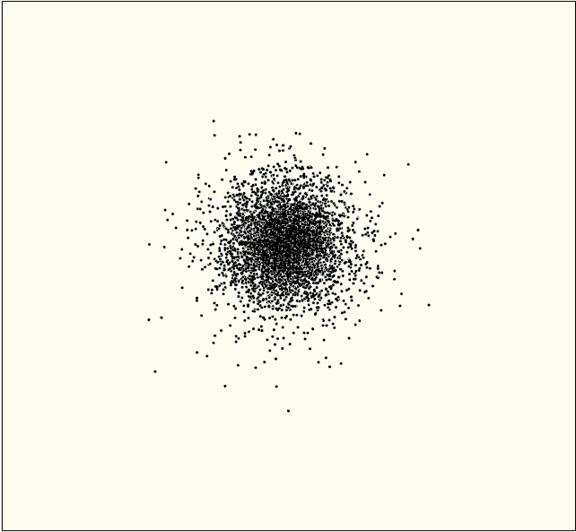
איור הבא מציג את האורביטל בצורה נכונה יותר: נקודות מסמלות את המקומות האפשריות בהם יכול להמצא האלקטרון. באזור בו צפיפות הנקודות גבוהה יותר יש סיכוי רב יותר להמצאות האלקטרון.
תכונת הגל של אלקטרון קובעת את סוג האורביטל
במכניקה קוונטית מצבו של אלקטרון במרחב תלת-מימדי מתואר על ידי משוואת שרדינגר (שנת 1926 )
פתרון של משוואה זאת נותן פונקציה גלית (Ψ=f(x, y, z
שמאפשרת להעריך את סיכוי למציאת האלקטרון במרחב מסויים סביב הגרעין
משוואת שרדינגר מאפשרת לאפיין התנהגות של כל אלקטרון באטום על ידי שלושה מספרים קוונטים: n,l,m
לפי חישובים של מכניקה קוונטית אורביטלים שונים גם בגודל וגם בצורה המרחבית שלהם
ישנם מספר סוגי אורביטלים להם צורות מרחביות שונות: s,p,d,f
כדי לראות אורביטלים באטומים שונים כנס לקישור הבא: [1]
בכל אורביטל יכולים להימצא שני אלקטרונים בעלי כיוני תנועה סיבובית (ספין) מנוגדים
באטומים עם מספר גדול של אלקטרונים הם מאכלסים קודם את האורביטל בעלת אנרגיה נמוכה ברמה גבוהה יותר ורק אחר כך אורביטלים ברמה גבוהה יותר. באיור ניתן לראות שלאורביטלים 3d אנרגיה גבוהה יותר מאורביטלים 4s ן-4p|.