רמות אנרגיה: הבדלים בין גרסאות
| שורה 1: | שורה 1: | ||
[[רמת אנרגיה]] היא כמות אנרגיה מוגדרת שיש ל[[אלקטרון]] באטום. | [[רמת אנרגיה]] היא כמות אנרגיה מוגדרת שיש ל[[אלקטרון]] באטום. | ||
* כל האלקטרונים באותה רמת אנרגיה הם בעלי כמות דומה של אנרגיה. ככל שלאלקטרון יש כמות אנרגיה נמוכה יותר, יש סיכוי גדול יותר שהוא יימצא קרוב לגרעין ,ולהיפך. | * כל האלקטרונים באותה רמת אנרגיה הם בעלי כמות דומה של אנרגיה. ככל שלאלקטרון יש כמות אנרגיה נמוכה יותר, יש סיכוי גדול יותר שהוא יימצא קרוב לגרעין ,ולהיפך. | ||
| − | * הוספת/קליטת אנרגיה לאלקטרונים ע"י קרינה, חימום או זרם חשמלי גורמת לעירור כלומר למעבר של האלקטרון מרמת אנרגיה נמוכה לגבוהה. המצב המעורר הוא מצב לא יציב ולאחר זמן אלקטרון פולט אנרגיה וחוזר לרמת האנרגיה המקורית, | + | * הוספת/קליטת אנרגיה לאלקטרונים ע"י קרינה, חימום או זרם חשמלי גורמת לעירור כלומר למעבר של האלקטרון מרמת אנרגיה נמוכה לגבוהה. המצב המעורר הוא מצב לא יציב ולאחר זמן אלקטרון פולט אנרגיה וחוזר לרמת האנרגיה המקורית. חזרה של אלקטרון לרמת האנרגיה המקורית מלווה בפליטת מנה של אנרגיה הנקראת קוונט. |
| + | ככל שההפרש בין רמת האנרגיה אליה הגיעה האלקטרון המעורר לבין רמת האנרגיה המקורית שלו גדול יותר, כך תפלט כמות אנרגיה גדולה יותר | ||
| + | |||
| + | |||
| + | |||
| + | [[תמונה:Energy or.jpg]] | ||
* האנרגיה שנפלטת/נקלטת במעבר האלקטרונים מרמת אנרגיה אחת לשניה היא מנתית (קוונטית) ולא רציפה, כלומר לא כל כמות אנרגיה מוספת תגרום לעירור, אלא רק כזו שתהיה כפולה של גודל מסויים. | * האנרגיה שנפלטת/נקלטת במעבר האלקטרונים מרמת אנרגיה אחת לשניה היא מנתית (קוונטית) ולא רציפה, כלומר לא כל כמות אנרגיה מוספת תגרום לעירור, אלא רק כזו שתהיה כפולה של גודל מסויים. | ||
'''אנלוגיה למדרגות''' : כדי לעלות במדרגה צריך להשקיע אנרגיה. אם אין מספיק אנרגיה לא נעלה מדרגה. אין ½ מדרגה. (בניגוד לקומות שאפשר להיתקע בין 2 קומות). הבעיה באנלוגיה שלא בהכרח שכל המדרגות בגודל שווה, כי לכל רמת אנרגיה יש את תכולת האנרגיה שלה. | '''אנלוגיה למדרגות''' : כדי לעלות במדרגה צריך להשקיע אנרגיה. אם אין מספיק אנרגיה לא נעלה מדרגה. אין ½ מדרגה. (בניגוד לקומות שאפשר להיתקע בין 2 קומות). הבעיה באנלוגיה שלא בהכרח שכל המדרגות בגודל שווה, כי לכל רמת אנרגיה יש את תכולת האנרגיה שלה. | ||
גרסה מתאריך 13:52, 30 בדצמבר 2009
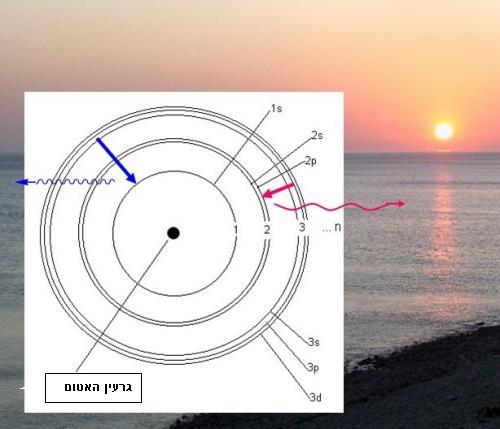
רמת אנרגיה היא כמות אנרגיה מוגדרת שיש לאלקטרון באטום.
- כל האלקטרונים באותה רמת אנרגיה הם בעלי כמות דומה של אנרגיה. ככל שלאלקטרון יש כמות אנרגיה נמוכה יותר, יש סיכוי גדול יותר שהוא יימצא קרוב לגרעין ,ולהיפך.
- הוספת/קליטת אנרגיה לאלקטרונים ע"י קרינה, חימום או זרם חשמלי גורמת לעירור כלומר למעבר של האלקטרון מרמת אנרגיה נמוכה לגבוהה. המצב המעורר הוא מצב לא יציב ולאחר זמן אלקטרון פולט אנרגיה וחוזר לרמת האנרגיה המקורית. חזרה של אלקטרון לרמת האנרגיה המקורית מלווה בפליטת מנה של אנרגיה הנקראת קוונט.
ככל שההפרש בין רמת האנרגיה אליה הגיעה האלקטרון המעורר לבין רמת האנרגיה המקורית שלו גדול יותר, כך תפלט כמות אנרגיה גדולה יותר
- האנרגיה שנפלטת/נקלטת במעבר האלקטרונים מרמת אנרגיה אחת לשניה היא מנתית (קוונטית) ולא רציפה, כלומר לא כל כמות אנרגיה מוספת תגרום לעירור, אלא רק כזו שתהיה כפולה של גודל מסויים.
אנלוגיה למדרגות : כדי לעלות במדרגה צריך להשקיע אנרגיה. אם אין מספיק אנרגיה לא נעלה מדרגה. אין ½ מדרגה. (בניגוד לקומות שאפשר להיתקע בין 2 קומות). הבעיה באנלוגיה שלא בהכרח שכל המדרגות בגודל שווה, כי לכל רמת אנרגיה יש את תכולת האנרגיה שלה.
- עירור האלקטרונים לרמות אנרגיה גבוהות יותר, סופו בחזרת האלקטרונים המעוררים לרמת האנרגיה המקורית, תוך כדי פליטת אנרגיה כיוון שזהו המצב היציב ביותר מבחינה אנרגתית (בגלל המשיכה בין האלקטרון לבין הגרעין). אולם, זה אינו שולל קיום של מצבים נוספים, פחות יציבים.
רמות אנרגיה באטום.
אלקטרונים באטום נמצאים במרחקים שונים מהגרעין - מחולקים ברמות אנרגיה שונות.
ככל שהמרחק בין הגרעין לבין האלקטרון הוא גדול יותר, כך אלקטרון נמצא ברמת האנרגיה גבווה יותר וכך יש לו כמות אנרגיה גדולה יותר.
אלקטרונים נעים על אורביטלים מוגדרים הנמצאים על רמות אנרגיה מוגדרות. מספר סוגי האורביטלים בכל רמת אנרגיה זהה למספר רמת האנרגיה ביחס לגרעין.
מספר אלקטרונים בכל רמת האנרגיה שונה, ככל שרמת האנרגיה רחוקה יותר מהגרעין כך מספר האלקטרונים הנמצאים באותה רמת האנרגיה גדול יותר .
הודות לתכונות הגל לכל אלקטרון באטום יש ערך אנרגטי מוגדר והוא תלוי במרחק של אותו אלקטרון מהגרעין.
אלקטרונים בעלי ערכים אנרגטיים דומים מאכלסים אותה רמת האנרגיה.מספר מקסימלי של אלקטרונים בכל רמת האנרגיה הוא 2n2
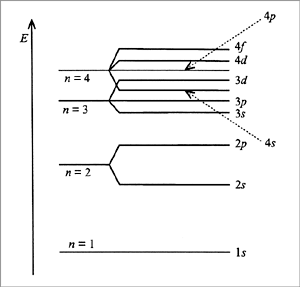
כל אלקטרון באטום מאופיין על ידי ארבעה מספרים קוונטיים:
מספר הראשי המציין את מספר רמת האנרגיה באטם
מספר אורביטלי המציין את הצורה המרחבית של האורביטל עליו נמצא האלקטרון
מספר קוונטי מגנטי המאפיין את המצב של האורביטל במרחב
מספר ספין המאפיין כיוון תנועת האלקטרון סביב ציר עצמי
איכלוס האורביטלים הנמצאים על רמות אנרגיה שונות מתבצע על פי כללים:
כלל פעולי: באטום אין שני אלקטרונים להם ארבעה מספרים קוונטים זהים - על כל אורביטל יכולים להיות רק שני אלקטרונים בעלי ספינים שונים.
כלל האנרגיה הנמוכה: כל אלקטרון ממוקם כך שאנרגיה שלו תהיהי מינימלית
כלל הונד: אטום במצב יציב יכיל מספר מקסימלי של אלקטרונים לא מזווגים
כל משבצת באיור מסמלת אורביטל ברמת האנרגיה מסויימת, מספר מקסימלי של אלקטרונים בכל אורביטל הוא 2.